题目内容
I.铝的阳极氧化能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸,模拟该生产过程如下:
(1)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜有关反应的离子方程式____________
(2)如图,组装好仪器,通电约25min。在阳极生成氧化铝,阴极产生气体。则该过程中阳极发生反应的电极式为______;该溶液pH的变化______(填:“增大”或“减小”或“不变”)
II现代社会对电池的需求越来越大,尤其足可充电的二次电池。
髙铁电池是一种新型可充电电池,总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
3Zn+2K2FeO4+8H2O,该电池放电时正极材料的化学式是 其电极反应式是______,若电路中通过1.204×1023个电子时,负极质量变化为______g充电时,该电池的正极接直流电源的______(填“正极”或“负极”)。
(16分)
Ⅰ.(1)Al2O3+2OH-+3H2O=2[Al(OH)4]-(2分)
(2)2Al+3H2O-6e-=Al2O3+6H+(2分);减小(2分)
Ⅱ.K2FeO4(1分)FeO42-+4H2O+3e-=Fe(OH)3+5OH-(2分);6.5(2分);正极(1分)
解析试题分析:
Ⅰ.(1)结合题目知氧化铝与NaOH反应:Al2O3+2OH-+3H2O=2[Al(OH)4]-
(2)铝在阳极放电在阳极生成氧化铝,2Al+3H2O-6e-=Al2O3+6H+;总反应2Al+6H2O=Al2O3+6H2↑,只是消耗水,所以酸的浓度增大,pH减小。
Ⅱ.总反应为:3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,正极材料的化学式是K2FeO4;负极反应:Zn+2OH--2e-=Zn(OH)2,可知正极电极反应式是FeO42-+4H2O+3e-=Fe(OH)3+5OH-;电路中通过1.204×1023个电子时,负极反应Zn0.1mol;充电时,该电池的正极应该发生氧化反应,做阳极,接在电源的正极。
3Zn+2K2FeO4+8H2O,正极材料的化学式是K2FeO4;负极反应:Zn+2OH--2e-=Zn(OH)2,可知正极电极反应式是FeO42-+4H2O+3e-=Fe(OH)3+5OH-;电路中通过1.204×1023个电子时,负极反应Zn0.1mol;充电时,该电池的正极应该发生氧化反应,做阳极,接在电源的正极。
考点:考查电池、电解池等相关知识。

近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .






 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。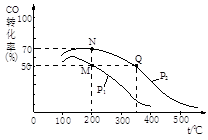
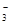 还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。