题目内容
把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为 ( )
| A.M + 3N mol | B.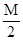 + 3N mol + 3N mol | C.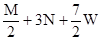 mol mol | D.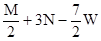 mol mol |
B
解析试题分析:加成反应前后原子守恒,M mol H2和N mol C2H4混合,C原子为2Nmol,H原子为4Nmol+2Mmol,
由C~O2、4H~O2,则消耗的氧气为2Nmol+(4Nmol+2Mmol)× =3Nmol+
=3Nmol+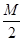 mol,故选B。
mol,故选B。
考点:考查化学反应方程式的计算

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
.(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如下图所示:
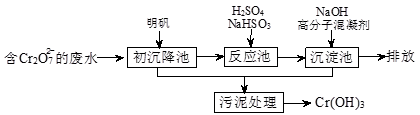
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
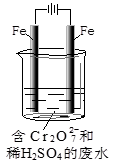
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
下列有关实验的叙述正确是( )
| A.将SO2通入溴水溶液中溴水褪色,可以说明SO2有漂白性 |
| B.将淀粉和稀硫酸混合后加热,再加入银氨溶液加热,可以检验淀粉水解后的产物 |
| C.将C2H5OH与浓硫酸170℃共热,制得的气体直接通入酸性KMnO4溶液,可以检验生成的乙烯气体 |
| D.向AgCl浊液中滴加KI溶液,白色沉淀转化为黄色沉淀,可以说明AgI比AgCl更难溶 |
化学在人类生活中扮演着重要角色,以下应用不正确的是( )
| A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
| B.福尔马林是一种良好的杀菌剂,能用来消毒饮用水 |
| C.医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| D.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |
下列根据事实所作出的结论正确的是
| 事实 | 结论 |
| A.完全燃烧产物是CO2和H2O的物质 | 一定只含C、H元素 |
| B.灼烧棉织品、羊毛衫和涤纶衣物 | 有烧焦羽毛气味的是羊毛衫 |
| C.在淀粉溶液中加入市售的加碘食盐不出现蓝色 | 不能说明此盐不含碘 |
| D.甲乙两种物质,相对分子质量相同,结构不同 | 甲和乙一定是同分异构体 |
下列实验方案能够达到预期目的的是( )
| A.区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 |
| B.检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 |
| C.乙醇的消去反应、皂化反应、淀粉的水解反应均可用浓硫酸作催化剂 |
| D.检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验 |