题目内容
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过):
制备原理:2CrO42-(黄色)+2H+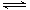 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO42-+4H2O="2" Cr2O72- + 4OH- +2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为 ;此时电路中转移电子的物质的量为 。
(每空2分,共8分)
(1)阳极产生无色气体,溶液由黄色逐渐变为橙色;
4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+
(2)2:1 ; 0.1 mol
解析试题分析:(1)电解池中阳极失去电子,发生氧化反应。则阳极是溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=O2↑+2H2O。由于OH-被电解,破坏了阳极周围水的电离平衡导致阳极周围溶液显酸性,则促进可逆反应向2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O正反应方向移动,所以阳极周围的实验现象是阳极产生无色气体,溶液由黄色逐渐变为橙色。
Cr2O72-(橙色)+H2O正反应方向移动,所以阳极周围的实验现象是阳极产生无色气体,溶液由黄色逐渐变为橙色。
(2)设溶液中K2CrO4和K2Cr2O7的物质的量分别是x和y,则(2x+2y):(x+2y)=3:2,解得x:y=2:1。38.8g K2CrO4的物质的量是38.8g÷194g/mol=0.2mol,所以根据Cr原子守恒可知,生成的K2Cr2O7的物质的量是0.05mol。根据方程式4CrO42-+4H2O=2 Cr2O72- + 4OH- +2H2↑+O2↑,每生成2molK2Cr2O7,反应中转移4mol电子,所以此时电路中转移电子的物质的量为0.05mol×4=0.1mol。
考点:考查电解原理的有关应用、判断和计算

近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .
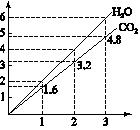
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是
①可能有C2H2
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H6
| A.②⑤ | B.②④ | C.③④ | D.②③ |
某含碳?氢?氧的有机物A能发生如图所示的变化:已知A?C?D?E均能在一定条件下与新制的氢氧化铜悬浊液反应生成红色沉淀,则A的同分异构体是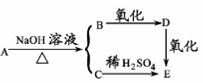
| A.乙酸 | B.甲酸乙酯 | C.甲酸甲酯 | D.乙酸甲酯 |
 Cu2++
Cu2++ CuCl+Cl- K=2.32
CuCl+Cl- K=2.32


 ,并测定其化学式。
,并测定其化学式。
 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。