题目内容
17.(1)某温度(t℃)时,水的KW=1×10-12,则该温度>(填“>”“<“或“=”)25℃,其理由是温度升高,水的电离程度增大,氢离子和氢氧根离子浓度增大;(2)该温度下,c(H+)=1×10-7mol•L-1的溶液呈碱性(填“酸性”“碱性”或“中性”);若该溶液中只有NaOH溶质,则H2O电离出来的c(OH-)=1×10-7mol•L-1.
(3)某温度下纯水中c(H+)=2×10-7mol•L-1,则此溶液中的c(OH-)=2×10-7mol•L-1.若温度不变,滴入稀盐酸使c(H+)=5×10-6mol•L-1,则此时溶液的c(OH-)=8×10-9mol•L-1.
分析 (1)水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大,通过比较(t℃)时和25℃时Kww的值判断;
(2)该温度下,中性溶液中c(H+)=1×10-6mol•L-1;水电离出来的氢离子浓度等于水电离出来的氢氧根的浓度;
(3)纯水中c(H+)=c(OH-),根据Kw=c(H+)×c(OH-)计算.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,氢离子和氢氧根离子浓度增大,则水的离子积常数增大,25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+)•c(OH-)=10-14 ,某温度(T℃)时,水的离子积常数Kw=1×10-12>10-14,则该温度大于25℃,
故答案为:>;温度升高,水的电离程度增大,氢离子和氢氧根离子浓度增大;
(2)该温度下,中性溶液中c(H+)=1×10-6mol•L-1,则c(H+)=1×10-7mol•L-1的溶液呈碱性;溶液中水电离出来的氢离子浓度等于水电离出来的氢氧根的浓度,则NaOH溶质,由H2O电离出来的c(OH-)=1×10-7mol•L-1;
故答案为:碱性;1×10-7;
(3)纯水中c(H+)=c(OH-),某温度下纯水中c(H+)=2×10-7mol•L-1,则c(OH-)=2×10-7mol•L-1;Kw=c(H+)×c(OH-)=(2×10-7)2=4×10-14,
则c(OH-)=$\frac{4×1{0}^{-14}}{5×1{0}^{-6}}$=8×10-9mol•L-1;
故答案为:2×10-7mol•L-1;8×10-9mol•L-1.
点评 本题考查了水的电离、离子积常数的有关计算,侧重于对学生计算能力和分析能力的考查,注意离子积只和温度有关.题目难度中等.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | 2gH2中含有的分子数为NA | |
| B. | 标准状况下,22.4LH2O中含有的分子数为NA | |
| C. | 1mol/L K2SO4的溶液中含有钾离子数为2NA | |
| D. | 1mol钠原子中含有的电子数为NA |
| A. | 氢氧化铁和稀硝酸反应 | B. | 氢氧化钡和稀盐酸反应 | ||
| C. | 氢氧化钾溶液中通入硫化氢气体 | D. | 氢氧化钡溶液和稀硫酸反应 |
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 裂化汽油与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与水在一定条件下反应制取乙醇 | |
| D. | 乙烷与氯气在一定条件下反应制取的一氯乙烷 |
| A. | 加入催化剂,反应速率加快,平衡常数也会随之变化 | |
| B. | 增加D的量,化学平衡逆向移动 | |
| C. | 增加A的量,B的转化率提高 | |
| D. | 平衡常数的表达式为K=$\frac{c(C)•c(D)}{c(A)^{2}•c(B)}$ |
| A. | 稀盐酸 | B. | 氢氧化钾溶液 | C. | 硫酸铜溶液 | D. | 食盐水 |
| T/℃ | 25 | 80 | 230 |
| K | 5×104 | 1 | 2×10-5 |
(1)升高温度,Ni的转化率减小(填“增大”“减小”或“不变”).
(2)在保持温度不变的情况下,要提高上述反应中Ni的转化率,可采取的一种措施是增大压强或降低温度或增加一氧化碳的浓度.
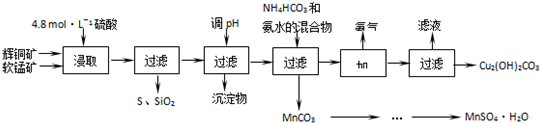
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.
(3)调节浸出液pH的范围为3.2≤PH<4.4,其目的是使Fe3+离子转化为氢氧化铁沉淀除去.
(4)本工艺中可循环使用的物质是NH3(写化学式).
(5)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).
d Fe3++e Br2+f Cl-.下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |