题目内容
12.在一定条件下,可逆反应2A(g)+B(g)?C(g)+D(s)达到平衡,下列说法正确的是( )| A. | 加入催化剂,反应速率加快,平衡常数也会随之变化 | |
| B. | 增加D的量,化学平衡逆向移动 | |
| C. | 增加A的量,B的转化率提高 | |
| D. | 平衡常数的表达式为K=$\frac{c(C)•c(D)}{c(A)^{2}•c(B)}$ |
分析 A、催化剂改变反应速率不改变化学平衡;
B、D为固体,不影响化学平衡;
C、两种反应物增加一种的量会提高另一种的转化率;
D、平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度的幂次方乘积}$,固体不写入表达式;
解答 解:A、催化剂改变反应速率不改变化学平衡,平衡常数随温度变化,所以平衡常数不变,故A错误;
B、D为固体生成物,增加D的量,不影响平衡,平衡不动,故B错误;
C、两种反应物增加一种的量会提高另一种的转化率,增加A的量,平衡正向进行,B的转化率提高,故C正确;
D、平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度的幂次方乘积}$=$\frac{c(C)}{{c}^{2}(A)c(B)}$,D为固体不写入平衡常数表达式,故D错误;
故选C.
点评 本题考查了化学平衡影响因素分析,平衡常数的表达方法,掌握化学平衡移动原理和反应特征是解题关键,题目较简单.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
2.发展绿色食品,避免“白色污染”,增强环境意识.其中绿色食品是指( )
| A. | 绿颜色的营养食品 | B. | 有叶绿素的营养食品 | ||
| C. | 经济附加值高的营养食品 | D. | 安全、无公害的营养食品 |
7.联苯的结构简式如图,(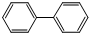 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )
 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )| A. | 分子中含有6个碳碳双键 | |
| B. | 1mol联苯最多可以和6molH2发生加成反应 | |
| C. | 它可以发生加成反应、取代反应,不易被酸性高锰酸钾氧化 | |
| D. | 它和蒽(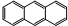 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
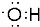 ;
;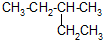 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷;
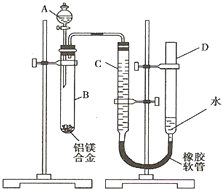 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: