题目内容
13.图1、图2为两套实验装置.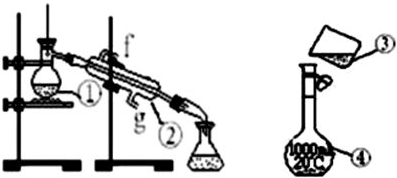
(1)写出下列仪器的名称:①蒸馏烧瓶;②冷凝管.
(2)仪器①-④中,使用时必须检查是否漏水的有④(填序号)
(3)若利用图Ⅰ装置制取蒸馏水,还缺少的仪器是酒精灯,将仪器补充完整后进行的实验操作的名称为:蒸馏,冷却水从g口进.
(4)现需配制1.0mol•L-1的NaOH溶液240mL,请完成下列问题:
(Ⅰ)配制溶液一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为②①③⑧⑤⑥⑦④
(Ⅱ)欲完成该实验,应称量10.0gNaOH
(Ⅲ)图2装置是某同学配制此溶液时转移操作的示意图,图中的错误是未用玻璃棒引流,未用250mL容量瓶
(Ⅳ)配制过程中下列操作会引起浓度偏低的是①②⑤
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.
分析 (1)熟悉仪器的构造,说出其名称;
(2)1000mL容量瓶带有瓶塞,使用过程中需要倒转,在使用前要检查是否漏水;
(3)利用图Ⅰ装置制取蒸馏水,实验名称为蒸馏,蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,为达到最佳冷凝效果,冷凝水应从冷凝管下口入,上口出;
(4)(Ⅰ)依据配制一定物质的量浓度溶液的一般步骤排序;
(ⅱ)依据配制溶液体积选择容量瓶规格,依据m=CVM计算需要溶质的质量;
(ⅲ)依据所配溶液的体积选择合适的容量瓶;倾倒溶液应用玻璃棒引流;
(ⅳ)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)图中仪器:①为蒸馏烧瓶;②为冷凝管;
故答案为:蒸馏烧瓶; 冷凝管;
(2)1000mL容量瓶带有瓶塞,使用过程中需要倒转,在使用前要检查是否漏水;
故答案为:④;
(3)利用图Ⅰ装置制取蒸馏水,实验名称为蒸馏;蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,所以还缺失的仪器为:酒精灯;为达到最佳冷凝效果,冷凝水应从冷凝管下口入,上口出,即从g口入;
故答案为:酒精灯,蒸馏,g;
(4)(ⅰ)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故答案为::②①③⑧⑤⑥⑦④;
(ⅱ)配制1.0mol•L-1的NaOH溶液240mL,实验室没有240mL容量瓶,应选择250mL容量瓶,实际配制溶液体积为250mL,需要溶质的质量m=1.0mol/L×0.25L×40g/mol=10.0g;
故答案为:10.0;
(ⅲ)配制1.0mol•L-1的NaOH溶液240mL,实验室没有240mL容量瓶,应选择250mL容量瓶;移液时应用玻璃棒引流;
故答案为:未用玻璃棒引流,未用250mL容量瓶;
(ⅳ)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故选;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故选;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故不选;
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故选;
故选:①②⑤.
点评 本题考查了蒸馏水的制备和一定物质的量浓度溶液的配制,明确蒸馏实验的原理和用到的仪器及注意事项、明确配制溶液原理和步骤是解题关键,题目难度不大.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案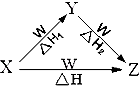 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是 ( ) ①C、CO
②AlCl3、Al(OH)3
③Fe、Fe(NO3)2
④Na2CO3、NaHCO3.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | 等物质的量的溴化亚铁与氯气2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 小苏打与甲酸溶液混合H++CO32-+HCOOH=CO2↑+HCOO-+H2O | |
| D. | 澄清石灰水中滴加少量碳酸氢钙溶液Ca2++OH-+HCO3-=H2O+CaCO3↓ |
| A. | 28.4 g | B. | 28.4 mol | C. | 71 L | D. | 71 g/mol |
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl Cu2++2OH-═Cu(OH)2↓ | |
| B. | BaCO3+2HCl═BaCl2+CO2↑十H2O CO${\;}_{3}^{2-}$十2H+═CO2↑十H2O | |
| C. | CaCl2+Na2CO3═CaCO3↓+2NaCl Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 2NaOH+H2SO4=Na2SO4十2H2O H++OH-═H2O |
| A. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| B. | 用热的纯碱溶液可区别植物油和矿物油 | |
| C. | 从溴水中提取溴可用植物油作萃取剂 | |
| D. | 生产盐酸和人造脂肪必须用氢气作原料 |