题目内容
9.(1)写出电子式:KCl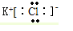 ;CO2
;CO2
(2)用电子式表示下列化合物的形成过程:
CaF2:

NH3:
 .
.
分析 (1)氯化钾为离子化合物,阴阳离子需要标出所带电荷;二氧化碳为共价化合物,C、O原子最外层都达到8电子稳定结构,据此写出其电子式;
(2)氟化钙为离子化合物,阴阳离子需要标出所带电荷,氟离子需要标出最外层电子;氨气为共价化合物,分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构,据此用电子式分别表示出氟化钙、氨气的形成过程.
解答 解:KCl为离子化合物,由钾离子与氯离子构成,电子式为: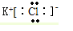 ;
;
CO2为共价化合物,其分子中存在两个碳氧双键,二氧化碳的电子式为 ,
,
故答案为: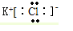 ;
; ;
;
(2)氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为: ;
;
氨气为共价化合物,分子中存在3个氮氢键,其形成过程为:3H•+ →
→ ,
,
故答案为: ;3H•+
;3H•+ →
→ .
.
点评 本题考查了用电子式表示化合物的形成过程,题目难度中等,明确电子式的书写方法为解答关键,注意掌握离子化合物与共价化合物的电子式的区别,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
17.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
| A. | 该晶体类型是原子晶体 | |
| B. | 该晶体中碳原子和氧原子的个数比为1:2 | |
| C. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| D. | 晶体的空间最小环共有6个原子构成 |
1.复合材料的优点是( )
①强度高 ②质量轻 ③耐高温 ④耐腐蚀.
①强度高 ②质量轻 ③耐高温 ④耐腐蚀.
| A. | 仅①④ | B. | 仅②③ | C. | 除③外 | D. | ①②③④ |
 3-甲基戊烷
3-甲基戊烷 2,2,3-三甲基丁烷
2,2,3-三甲基丁烷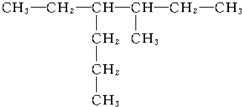 3-甲基-4-乙基庚烷
3-甲基-4-乙基庚烷 2,5-二甲基-3-乙基戊烷
2,5-二甲基-3-乙基戊烷 3,4-二甲基-5-乙基辛烷
3,4-二甲基-5-乙基辛烷 3-甲基-4-乙基己烷.
3-甲基-4-乙基己烷.