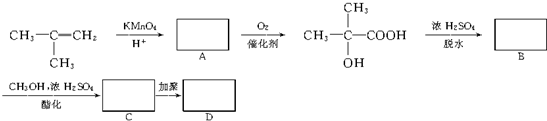
题目内容
18.某有机物A在常温下为无色液体,取一定量该液体,在一定条件下汽化,体积为V L,在其中通入4V L氧气,所得混合气体点火后恰好完全燃烧,生成的CO2和H2O(气)体积相等.将反应后混合气体恢复到原来温度(此时水仍为气体),测得其密度为反应前的5/6.求A的分子式和结构简式.分析 将反应后混合气体恢复到原来温度(此时水仍为气体),测得其密度为反应前的5/6,由于反应前后气体总质量不变,根据密度与气体体积成反比可以计算出水和二氧化碳的体积,据此可计算出A分子中含有C、H原子数,再根据氧元素质量守恒计算出A分子中含有的O原子数,从而得出A的分子式;然后根据A的分子式判断其可能的结构简式.
解答 解:将反应后混合气体恢复到原来温度(此时水仍为气体),测得其密度为反应前的5/6,反应前后气体总质量不变,密度与气体体积成反比,则反应后气体体积为:(V+4V)L×$\frac{6}{5}$=6V,
混合气体点火后恰好完全燃烧,生成的CO2和H2O(气)体积相等,则反应后生成了3VLCO2和3VLH2O(气),
则A分子中含有C、H原子数为:N(C)=$\frac{3VL}{1VL}$=3、N(H)=$\frac{3VL×2}{1VL}$=6,
根据氧元素质量守恒可知,A分子中含有O原子数为:N(O)=$\frac{3VL×2+3V-4V×2}{1V}$=1,
所以A的分子式为:C3H6O,其不饱和度为:$\frac{3×2+2-6}{2}$=1,说明A分子中含有1个醛基或羰基,
则A可能的结构简式为:CH3CH2CHO或 ,
,
答:A的分子式为C3H6O,可能的结构简式为CH3CH2CHO或 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确反应前后密度与气体体积的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式的方法.

练习册系列答案
相关题目
8.在氧化还原反应中,下列叙述正确的是( )
| A. | 物质失电子的反应为还原反应 | |
| B. | 物质在变化中失去电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
13.下列离子方程式中,不正确的是( )
| A. | C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | C6H5OH+OH-→C6H5O-+H2O | |
| C. | CH3CHO+2[Ag(NH3)2]++2OH-→CH3COONH4+2Ag↓+3NH3+H2O | |
| D. | CH3CHO+2[Ag(NH3)2]++2OH-→CH3COO-+NH4++2Ag↓+3NH3+H2O |
3.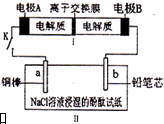 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
 如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
如图所示装置是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )| A. | 负极反应为2S22--2e-=S42- | |
| B. | 当有0.01 mol Na+通过离子交换膜时,b电极上析出气体112 mL | |
| C. | 闭合K后,b电极附近的pH变小 | |
| D. | 闭合K后,a电极上有气体产生 |
7.部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 在NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| B. | 向NaCN溶液中通入少量CO2的离子方程式:2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(HCOONa) |
8.己知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
 ;CO2
;CO2

 .
.