题目内容
19.硫酸氢钠溶于水的电离方程式为NaHSO4═Na++H++SO42-,它不是(填“是”或“不是”)酸.向硫酸氢钠溶液中加入以下物质时,离子方程式分别为:(1)NH3•H2ONH3•H2O+H+=NH4++H2O;
(2)NaHCO3溶液HCO3-+H+=H2O+CO2↑;
(3)滴入少量Ba(OH)2溶液Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(4)滴入过量Ba(OH)2溶液Ba2++OH-+H++SO42-═BaSO4↓+H2O;
(5)逐滴加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,中性溶液中,继续滴加Ba(OH)2溶液:Ba2++SO42-=BaSO4↓.
分析 硫酸氢钠为强电解质在朔州完全电离生成氢离子、钠离子、硫酸根离子;
电离产生阳离子全部为氢离子的化合物属于酸;
(1)硫酸氢钠中加入氨水反应实质为氢离子与一水合氨反应生成水和氨根离子;
(2)加入NaHCO3溶液,反应实质为氢离子与碳酸氢根离子反应生成水和二氧化碳;
(3)少量氢氧化钡溶液滴到硫酸氢钠溶液中,氢氧化钡完全反应,生成硫酸钡、硫酸钠、水;
(4)加入Ba(OH)2溶液至中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;
(5)至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.
解答 解:硫酸氢钠为强电解质在朔州完全电离生成氢离子、钠离子、硫酸根离子,电离方程式为:NaHSO4═Na++H++SO42-,阳离子不全是氢离子,所以不是酸;
故答案为:NaHSO4═Na++H++SO42-;不是;
(1)硫酸氢钠中加入氨水反应实质为氢离子与一水合氨反应生成水和氨根离子,离子方程式:NH3•H2O+H+=NH4++H2O;
故答案为:NH3•H2O+H+=NH4++H2O;
(2)NaHCO3溶液与硫酸氢钠溶液反应离子方程式:HCO3-+H+=H2O+CO2↑;
故答案为:HCO3-+H+=H2O+CO2↑;
(3)少量氢氧化钡溶液滴到硫酸氢钠溶液中,氢氧化钡完全反应,生成硫酸钡、硫酸钠、水,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(4)过量氢氧化钡溶液滴到硫酸氢钠溶液中,硫酸氢钠完全反应,生成硫酸钡、水、NaOH,离子反应为Ba2++OH-+H++SO42-═BaSO4↓+H2O,
故答案为:Ba2++OH-+H++SO42-═BaSO4↓+H2O;
(5)硫酸氢钠中逐滴加入Ba(OH)2溶液至中性,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查了离子方程式的书写,明确硫酸氢钠的电离方式是解题关键,注意反应物用量对反应的影响,题目难度不大.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 制Cl2:MnO2、盐酸(稀) | B. | 制H2:硝酸(稀)、Zn | ||
| C. | 制O2:MnO2、H2O2 | D. | 制CO2:硫酸(稀)、CaCO3 |
| A. | 浓硫酸与稀硫酸具有强氧化性 | |
| B. | 某强酸性溶液中含有较多的SO32-、S2- | |
| C. | SO2、H2SO3、H2S都具有还原性 | |
| D. | 加BaCl2溶液生成白色沉淀,原溶液中一定含有SO42- |
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将蒸发皿放置在三脚架上直接用酒精灯火焰加热 |
| A. | NH4+、Mg2+ | B. | Mg2+、Fe2+ | C. | NH4+、Fe2+ | D. | Mg2+、Al3+ |
①煤的燃烧 ②燃放鞭炮 ③工业废气的排放 ④汽车的尾气.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
| A. | 物质失电子的反应为还原反应 | |
| B. | 物质在变化中失去电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
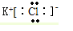 ;CO2
;CO2

 .
.