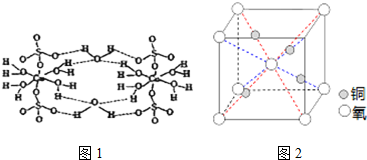
题目内容
3.下列离子方程式中,不正确的是( )| A. | 向Al2(SO4)3溶液中滴入过量氨水:Al3++4NH3•H2O=AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 向NaOH溶液中通入Cl2:2OH-+Cl2=Cl-+ClO-+H2O | |
| C. | 向CaCO3中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
分析 A.氨水为弱碱,反应生成氢氧化铝沉淀;
B.氯气与氢氧化钠溶液反应生成硫化钠、次氯酸钠和水;
C.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水;
D.氯气少量,亚铁离子还原性大于溴离子,则只有亚铁离子被氯气氧化.
解答 解:A.向Al2(SO4)3溶液中滴入过量氨水,反应生成的是氢氧化铝,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向NaOH溶液中通入Cl2,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,故B正确;
C.向CaCO3中加入稀盐酸,碳酸钙需要保留化学式,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C正确;
D.FeBr2溶液中通入少量的Cl2,亚铁离子的还原性大于溴离子,则亚铁离子优先被氧化,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故D正确;
故选A.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.物质的量相等的下列烃,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | C2H6 | B. | C3H6 | C. | C4H6 | D. | C7H16 |
11.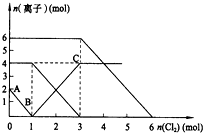 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br- 2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 原混合溶液中FeBr2的物质的量为2mol |
15.下列各组物质中化学键和晶体类型都相同的是( )
| A. | HCl NaCl | B. | SiO2 CO2 | C. | CaCl2 ?CCl4 | D. | PH3 SO2 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.1 mol组成为C2H6O的有机物,所含C-H键数目可能为0.5NA | |
| B. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| C. | 0.1 mol N2与0.3 mol H2在密闭容器中,在催化剂作用下充分反应,生成氨分子数为0.2NA | |
| D. | 标准状况下,22.4 L HF所含的分子数目为NA |
13.下列说法中不正确的是( )
| A. | 在金属单质中,钠的熔点较低 | |
| B. | 钠在发生化学反应时化合价升高 | |
| C. | 钠在空气中燃烧生成氧化钠,并发生黄色火焰 | |
| D. | 钠原子最外层只有一个电子,容易失电子 |
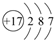 .
. .
.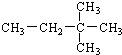 2,2-二甲基-丁烷
2,2-二甲基-丁烷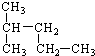 2-甲基-戊烷.
2-甲基-戊烷.