题目内容
15.下列各组物质中化学键和晶体类型都相同的是( )| A. | HCl NaCl | B. | SiO2 CO2 | C. | CaCl2 ?CCl4 | D. | PH3 SO2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,含离子键的一定为离子晶体,由分子构成的为分子晶体,含共价键且由原子构成为原子晶体,以此来解答.
解答 解:A.HCl含共价键,为分子晶体,而NaCl含离子键,为离子晶体,故A不选;
B.均只含共价键,分别为原子晶体、分子晶体,故B不选;
C.CaCl2含离子键,为离子晶体,而CCl4含共价键,为分子晶体,故C不选;
D.均只含共价键,均为分子晶体,故D选;
故选D.
点评 本题考查离子键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及晶体类型的判断,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
3.下列离子方程式中,不正确的是( )
| A. | 向Al2(SO4)3溶液中滴入过量氨水:Al3++4NH3•H2O=AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 向NaOH溶液中通入Cl2:2OH-+Cl2=Cl-+ClO-+H2O | |
| C. | 向CaCO3中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
10.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 油脂 | C. | 聚乙烯 | D. | 硝酸纤维 |
20.下列物质属于离子化合物的是( )
| A. | SiO2 | B. | CCl4 | C. | NaCl | D. | H2O |
4.下列反应中,硝酸只体现氧化性的是( )
| A. | CuO+HNO3 | B. | Cu+HNO3 | C. | FeO+HNO3 | D. | C+HNO3(浓) |
5.下列反应不能用H++OH -═H2O表示的是( )
| A. | NaOH 与H2SO4反应 | B. | KOH与盐酸反应 | ||
| C. | Ba(OH)2 与硫酸反应 | D. | Ba(OH)2与硝酸反应 |
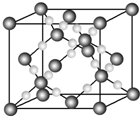 A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、C、D可形成常见的气态单质,A、E最外层电子数与其电子层数相等.B、F同主族,B元素基态原子核外电子平均分布在3个不同的能级上.C元素原子的最高能级上有3个未成对电子.F的一种单质与FD2晶体类型相同.
A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、C、D可形成常见的气态单质,A、E最外层电子数与其电子层数相等.B、F同主族,B元素基态原子核外电子平均分布在3个不同的能级上.C元素原子的最高能级上有3个未成对电子.F的一种单质与FD2晶体类型相同.