题目内容
12.下列说法中正确的是( )| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
分析 A.碳碳双键键能小于碳碳单键的2倍;
B.名称相同的能级轨道数相同;
C.电负性相差较大的元素之间极性大;
D.在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低.
解答 解:A.碳碳双键键能小于碳碳单键的2倍,导致碳碳双键较活泼,能发生加成反应,故A错误;
B.名称相同的能级轨道数相同,所以同一原子中,2p,3p,4p能级的轨道数相同,故B错误;
C.电负性相差较大的元素之间极性大,C-O元素之间电负性之差大于N-O之间电负性差,所以C-O键的极性比N-O键的极性大,故C正确;
D.在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,但不一定是近的轨道能量低,例如3d>4s,故D错误;
故选C.
点评 本题考查化学键、能级、电负性、能量最低原理等知识点,侧重基础知识的考查,知道极性大小判断方法、杂化轨道理论内涵,题目难度不大.

练习册系列答案
相关题目
3.去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )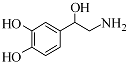

| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有2个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
20.下列反应的产物中,可能有两种互为同分异构体物质生成是( )
| A. | 丙烯与氯化氢加成 | B. | 2-溴丙烷与NaOH醇溶液共热 | ||
| C. | 1-溴丁烷与NaOH醇溶液共热 | D. | 1-溴丙烷与NaOH溶液共热 |
7.下列有关晶体和非晶体的说法中正确的是( )
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
17.下列溶液中各含三种阳离子,若在溶液中加入少量氨水时,三种离子皆产生沉淀;加入过量氨水则三种沉淀皆溶解.符合条件的是( )
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
4.反应A2(气)+B2(气)═2AB(气)的能量变化如图所示,下列说法正确的是( )
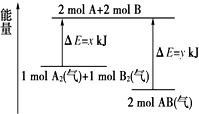

| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
1.下列有关用途的说法中,错误的是( )
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ