题目内容
16.有机物A、B、C、D、E有如下转化关系,D的相对分子质量为120,60gD完全燃烧,生成4molCO2和36gH2O,B是芳香化合物
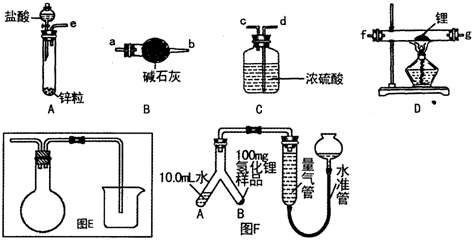
已知:-CHO+
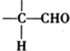 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$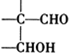 -CHO+
-CHO+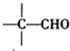 +NaOH(浓)→
+NaOH(浓)→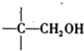 +
+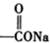
请回答下列问题:
(1)已知C是一种羧酸,其结构简式为HOCH2COOH
(2)D的分子结构中可能共平面的原子最多有15个
(3)下列关于A的叙述正确的是ad(填写字母编号)
a.1molA最多能与4molH2反应
b.能发生消去反应
c.其核磁共振氢谱有6组峰
d.能发生氧化反应
(4)反应①的化学方程式是
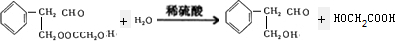
(5)链状有机物F与C的相对分子质量相等,含元素种类相同,1molF能与2molNa反应,满足该条件的F的结构简式是CH2OHCHOHCH3、CH2OHCH2CH2OH(不考虑立体异构,同一个碳原子上不能连接两个羟基)
(6)以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成G,G的结构简式为C(CH2OH)4,则合成G各步反应的化学方程式是CH3CHO+3HCHO$\stackrel{稀NaOH溶液}{→}$(CH2OH)3CCHO,(CH2OH)3CCHO+HCHO+NaOH(浓)→C(CH2OH)4+HCOONa.
分析 D的相对分子质量为120,60gD完全燃烧,生成4molCO2和36gH2O,有机物的物质的量为0.5mol,生成水的物质的量为2mol,则有机物含有8个C、8个H,由B是芳香化合物可知D含有苯环,结合信息可知D应为 ,B为
,B为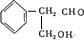 ,已知C是一种羧酸,由分子式以及E可知C应为HOCH2COOH,则A为
,已知C是一种羧酸,由分子式以及E可知C应为HOCH2COOH,则A为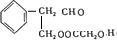 ,以此解答该题.
,以此解答该题.
解答 解:D的相对分子质量为120,60gD完全燃烧,生成4molCO2和36gH2O,有机物的物质的量为0.5mol,生成水的物质的量为2mol,则有机物含有8个C、8个H,由B是芳香化合物可知D含有苯环,结合信息可知D应为 ,B为
,B为 ,已知C是一种羧酸,由分子式以及E可知C应为HOCH2COOH,则A为
,已知C是一种羧酸,由分子式以及E可知C应为HOCH2COOH,则A为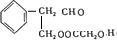 ,
,
(1)由以上分析可知C为HOCH2COOH,故答案为:HOCH2COOH;
(2)D为 ,分子中具有苯环和醛基等平面形结构,由三点确定一个平面可知最多有15个原子共平面,故答案为:15;
,分子中具有苯环和醛基等平面形结构,由三点确定一个平面可知最多有15个原子共平面,故答案为:15;
(3)A为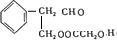 ,
,
a.能与氢气发生加成反应的为苯环和醛基,1molA最多能与4molH2反应,故a正确;
b.羟基邻位没有氢原子,不能发生消去反应,故b错误;
c.由结构简式可知其核磁共振氢谱有8组峰,故c错误;
d.含有醛基,能发生氧化反应,故d正确.
故答案为:ad;
(4)A为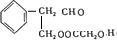 ,水解生成
,水解生成 和HOCH2COOH,方程式为
和HOCH2COOH,方程式为 ,
,
故答案为: ;
;
(5)C为HOCH2COOH,链状有机物F与C的相对分子质量相等,为76,含元素种类相同,1molF能与2molNa反应,说明含有2个羟基,分子式为C3H8O2,则满足该条件的F的结构简式是CH2OHCHOHCH3或CH2OHCH2CH2OH,故答案为:CH2OHCHOHCH3;CH2OHCH2CH2OH;
(6)由题给信息可知,可先由乙醛和甲醛反应生成(CH2OH)3CCHO,然后在浓氢氧化钠溶液中反应生成C(CH2OH)4,反应的方程式分别为CH3CHO+3HCHO$\stackrel{稀NaOH溶液}{→}$(CH2OH)3CCHO、(CH2OH)3CCHO+HCHO+NaOH(浓)→C(CH2OH)4+HCOONa,
故答案为:CH3CHO+3HCHO$\stackrel{稀NaOH溶液}{→}$(CH2OH)3CCHO、(CH2OH)3CCHO+HCHO+NaOH(浓)→C(CH2OH)4+HCOONa.
点评 本题考查了有机物的推断,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握提给信息,明确有机物的官能团及其性质是解本题关键,难度中等.

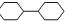 ,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )
,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )| A. | 13 | B. | 12 | C. | 11 | D. | 10 |
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,有固定的熔点,可以使X光发生有规律的衍射 | |
| C. | 晶体研碎后即变为非晶体 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
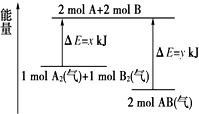
| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
| A. | 一定有H2、CO2和HCl | B. | 一定有CO、CO2和水蒸气 | ||
| C. | 一定没有CO2,肯定有H2 | D. | 可能有CO2、NH3和水蒸气 |
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中找寻半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | SiO2是光导纤维的成分 |
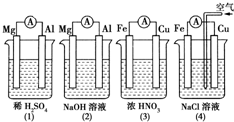
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
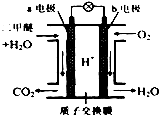 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |