题目内容
20.硫及其化合物在生产及生活中有着广泛的应用.(1)硫单质的结构有多种形式,其中一种的球棍模型如图(
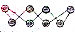 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.(2)有200mL含有BaCl2和Ba(NO3)2的稀溶液,将其均匀分为两份,向其中一份中缓慢通入足量SO2,最终得到a mol沉淀(设硫元素全部转化为沉淀),此过程中的(总)反应离子方程式为:3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO.原溶液中c(NO3-)=$\frac{20a}{3}$(用含a的数值表示);向另一份溶液中加入0.005mol SO3后,溶液的pH的值为1.
(3)Al2S3只能用干法制备而不能用湿法制备,其原因是(用方程式表示)Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(4)Na2S2O3常用语准确测量碘溶液中c(I2),某同学准确量取20.00mL碘的溶液及适当的指示剂并置于锥形瓶中,然后用Na2S2O3标准溶液滴定至终点,最终消耗了浓度为c mol/L的Na2S2O3溶液V mL(滴定中的反应为:2S2O32-+I2═2I-+S4O62-)则滴定中点观察到的现象为溶液由蓝色变化为无色,溶液中c(I2)=0.025cVmol/L.
(5)BaSO4既难溶于水也难溶于一般的酸,但可利用Na2CO3溶液、盐酸将其转化为BaCl2,已知25℃时,Ksp(BaSO4)=1.0×10-10;Ksp(BaCO3)=2.5×10-9,则BaSO4转化为BaCO3反应的平衡常数K=0.04,若用浓度为2.5mol/L的Na2CO3溶液溶解1mol BaSO4,则所用Na2CO3溶液的体积至少为10L(忽略溶液体积的变化).
分析 (1)硫单质和氢氧化钠溶液反应生成亚硫酸钠,硫元素化合价升高,则另一种生成物质是硫元素化合价降低生产的硫化钠,结合原子守恒和电荷守恒书写得到离子方程式;
(2)向含有BaCl2 和Ba(NO3)2 的稀溶液缓慢加入足量的SO2,发生3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO,以此可计算c(NO3- ),溶液中加入0.005mol SO3,首先发生SO3+H2O=2H++SO42-,以此计算液的pH的值;
(3)Al2S3是弱酸弱碱盐,与水发生双水解反应生成氢氧化铝和硫化氢,据此书写;
(4)反应原理中,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点;根据反应I2+2S2O32-═2I-+S4O62-,根据关系式计算出碘单质的物质的量,再根据c=$\frac{n}{V}$计算浓度;
(5)一定浓度下,硫酸钡可以转化为碳酸钡沉淀,结合溶度积常数计算得到反应的平衡常数,根据沉淀转化的定量关系计算溶解1mol硫酸钡需要的碳酸钠物质的量,c=$\frac{n}{V}$计算得到溶液体积.
解答 解:(1)硫单质和氢氧化钠溶液反应 单质的歧化反应,生成亚硫酸钠,硫元素化合价升高,则另一种生成物质是硫元素化合价降低生产的硫化钠,结合原子守恒和电荷守恒书写得到离子方程式为:3S8+48OH-=16S2-+8SO32-+24H2O;
故答案为:3S8+48OH-=16S2-+8SO32-+24H2O;
(2)向含有BaCl2 和Ba(NO3)2 的稀溶液缓慢加入足量的SO2,发生3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO,
n(NO3- )=$\frac{2}{3}$n(SO2)=$\frac{2}{3}$amol,
c(NO3- )=$\frac{2}{3}$×$\frac{amol}{0.1L}$=$\frac{20a}{3}$mol/L,
溶液中加入0.005mol SO3,首先发生SO3+H2O=2H++SO42-,n(H+)=2n(SO3)=0.01mol,
n(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=1,
故答案为:3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO;$\frac{20a}{3}$mol/L;1;
(3)Al2S3是弱酸弱碱盐,与水发生双水解反应,其反应为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑,所以Al2S3固体的制备过程中不能有水;
故答案为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑;
(4)反应原理中,碘单质遇到淀粉显示蓝色,可选淀粉为指示剂;当碘单质完全反应后溶液由蓝色变为无色,据此判断滴定终点,准确量取20.00mL碘的溶液及适当的指示剂并置于锥形瓶中,然后用Na2S2O3标准溶液滴定至终点,最终消耗了浓度为c mol/L的Na2S2O3溶液V mL(滴定中的反应为:2S2O32-+I2═2I-+S4O62-),根据反应I2+2S2O32-═2I-+S4O62-,
1 2
n cmol/L×V×10-3L
n=5cV×10-4mol
再根据计算c(I2)=$\frac{n}{V}$=$\frac{5cV×1{0}^{-4}mol}{0.020L}$=0.025cVmol/L;
故答案为:0.025cVmol/L;
(5)CO32-+BaSO4=BaCO3+SO42-
K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.0×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04,
设需要碳酸钠溶液体积为VL,则反应后c(SO42-)=$\frac{1}{V}$mol/L,
若用浓度为2.5mol/L的Na2CO3溶液溶解1mol BaSO4,K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{\frac{1}{V}mol/L}{2.5mol/L}$=0.04,V=10L;
故答案为:0.04;10.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握离子方程式的书写,为解答该题的关键,难度中等.

| A. | 煤经过分馏可得到焦炉气、煤焦油和焦炭 | |
| B. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、淀粉、油脂均能发生水解反应 |
| A. | 电解水 | B. | 干冰受热直接变成气体 | ||
| C. | HCl溶解于水 | D. | 打雷放电时,O2变成O3 |
| A. | X可能是第二周期非金属元素 | B. | X可能是第三周期金属元素 | ||
| C. | Y可能与X同主族 | D. | Y可能是金属元素 |
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
②反应A后调节溶液的pH范围应为3.2-4.2.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
④造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高.
(2)已知在某温度下Fe(OH)3的容度积常数Ksp=[Fe(OH)3]=1.0×10-38,已知在该温度下溶液中Fe3+离子浓度小于1×10-5mol/L时,该离子已沉淀完全.则该沉淀完全所需要的pH为3.3.
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | |
| 2 | 0.1mol | 0.3mol | 0.1mol |
| A. | 只有K+的物质的量相等 | B. | 只有Cl-的物质的量相等 | ||
| C. | 完全相同 | D. | 各离子的物质的量完全不同 |
| A. | 酒精 | B. | K2SO4晶体 | C. | 熔融NaCl | D. | Cu |