题目内容
10.比较氢氧化钡、氢氧化钙、氢氧化锂、氢氧化钠的碱性,并设计实验方案.分析 同一周期从左到右,失电子能力递减,同一主族从上到下,失电子能力递增,钠与钡不在同一周期也不在同一主族,铷在钠的下面,失电子能力铷大于钠,所以碱性氢氧化铷大于氢氧化钠,锂在第ⅠA族钠的上方,氢氧化锂碱性小于氢氧化钠,根据元素周期表中的对角线规则.铷与钡在周期表中处于对角线位置,性质相似.氢氧化钡活泼性与氢氧化铷相差不大.所以氢氧化钠的碱性比氢氧化钡的小,同主族中氢氧化钙碱性小于氢氧化钡,根据金属活泼性顺序表:Ba>Ca>Na>Li,据此分析判断溶液碱性强弱;
配制相同浓度为0.1mol/L的四种溶液,利用测定溶液PH的方法比较溶液碱性强弱.
解答 解:由周期表中递变规律和金属性强弱可知,同一周期从左到右,失电子能力递减,同一主族从上到下,失电子能力递增.钠与钡不在同一周期也不在同一主族,但可以用铷同一主族.铷在钠的下面,失电子能力铷大于钠,所以碱性氢氧化铷大于氢氧化钠,锂在第ⅠA族钠的上方,氢氧化锂碱性小于氢氧化钠,根据元素周期表中的对角线规则.铷与钡在周期表中处于对角线位置,性质相似.氢氧化钡活泼性与氢氧化铷相差不大.所以氢氧化钠的碱性比氢氧化钡的小,同主族中氢氧化钙碱性小于氢氧化钡,根据金属活泼性顺序表:Ba>Ca>Na>Li,所以元素最高价氧化物对应水化物的碱性氢氧化钙大于氢氧化钠,溶液浓度相同时,氢氧化钡、氢氧化钙、氢氧化锂、氢氧化钠的碱性大小为:氢氧化钡>氢氧化钙>氢氧化钠>氢氧化锂;
实验方案为:先配制相同浓度为0.01mol/L的氢氧化钡、氢氧化钙、氢氧化锂、氢氧化钠四种稀溶液,分别用玻璃棒蘸取四种溶液,滴在表面皿上的四条PH试纸的中间,变色后和比色卡对比得到溶液PH,比较PH大小得到碱性强弱;
答:溶液浓度相同时,氢氧化钡、氢氧化钙、氢氧化锂、氢氧化钠的碱性大小为:氢氧化钡>氢氧化钙>氢氧化钠>氢氧化锂;
配制相同浓度为0.01mol/L的氢氧化钡、氢氧化钙、氢氧化锂、氢氧化钠四种稀溶液,分别用玻璃棒蘸取四种溶液,滴在表面皿上的四条PH试纸的中间,变色后和比色卡对比得到溶液PH,比较PH大小得到碱性强弱.
点评 本题考查了金属性强弱的比较依据、实验方法和实验设计,掌握基础是关键,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| 元素 | Li | Na | K | O | O- | F |
| 电子亲合能/kJ•mol-1 | 59.8 | 52.7 | 48.4 | 141 | -780 | 327.9 |
| A. | 电子亲合能越大,说明越容易得到电子 | |
| B. | 一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量 | |
| C. | 元素的第一电子亲和能同主族的从上到下逐渐减小,同周期从左到右则逐渐增大 | |
| D. | 基态的气态氧原子得到两个电子成为O2-需要吸收能量 |
| A. | 在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子 | |
| B. | 在28g晶体硅中,含Si-Si共价键个数为4NA | |
| C. | 金刚石的熔沸点高于晶体硅,是因为C-C键键能小于Si-Si键 | |
| D. | 镁型和铜型金属晶体的配位数均为12 |
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
| A. | 通入足量的酸性KMnO4溶液 | B. | 在Ni催化、加热条件下通入H2 | ||
| C. | 通过足量的溴水 | D. | 通过足量的NaOH溶液 |
| A. | AlCl3溶液中滴加足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 铜片与浓HNO3:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O | |
| C. | NH4HCO3溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 一水合氨的电离:NH3•H2O=NH4++OH- |
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,2,4-三甲基-1-丁醇 | D. | 2,3-二乙基-1-戊烯 |
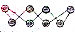 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.