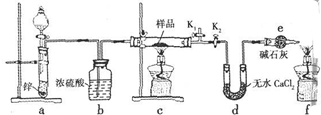
题目内容
20.X,Y,Z,W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y单质在空气中燃烧生成一种淡黄色固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方,请回答:(1)X元素在周期表中的位置是第二周期ⅣA族;W-离子的结构示意图为
 ;
;(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为
 ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;(3)写出一种适宜实验室制取W单质的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)室温时金即可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为Au+4HCl+HNO3=HAuCl4+NO↑+2H2O.
分析 X,Y,Z,W是原子序数依次增大的短周期元素,Y单质在空气中燃烧生成一种淡黄色固体,该固体为过氧化钠,则Y为Na元素;Z元素最高化合价与最低化合价绝对值之差等于4,则Z的最高化合价为+6、最低价为-2,Z的原子序数大于Na,则Z为S元素;W元素在周期表中位于非金属性最强的元素下方,非金属性最强的为F,则W为Cl元素;X元素的族序数是周期序数的2倍,最外层最多含有8个电子,X的原子序数小于Na,则X处于第二周期,族序数为Ⅳ,故X为C元素,据此进行解答.
解答 解:X,Y,Z,W是原子序数依次增大的短周期元素,Y单质在空气中燃烧生成一种淡黄色固体,该固体为过氧化钠,则Y为Na元素;Z元素最高化合价与最低化合价绝对值之差等于4,则Z的最高化合价为+6、最低价为-2,Z的原子序数大于Na,则Z为S元素;W元素在周期表中位于非金属性最强的元素下方,非金属性最强的为F,则W为Cl元素;X元素的族序数是周期序数的2倍,最外层最多含有8个电子,X的原子序数小于Na,则X处于第二周期,族序数为Ⅳ,故X为C元素,
(1)X元素为C元素,其原子序数为6,在周期表中的处于第二周期ⅣA族;W-离子为氯离子,其原子序数为17,最外层含有18个电子,氯离子的结构示意图为: ,
,
故答案为:第二周期ⅣA族; ;
;
(2)X为C元素,C元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物为乙炔,分子式为C2H2,乙炔为共价化合物,其分子中含有碳碳三键,乙炔的电子式为: ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,1mol乙炔的质量为:26g/mol×1mol=26g,26g乙炔放出的热量为:5×104kJ•kg-1×0.026g=1300kJ,则其标准燃烧热为-1300kJ/mol,
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,1mol乙炔的质量为:26g/mol×1mol=26g,26g乙炔放出的热量为:5×104kJ•kg-1×0.026g=1300kJ,则其标准燃烧热为-1300kJ/mol,
故答案为: ;-1300kJ/mol;
;-1300kJ/mol;
(3)W为Cl元素,其单质为氯气,实验室中用浓盐酸与二氧化锰加热反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)室温时金即可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,该反应中硝酸为氧化剂、金为还原剂,说明该反应中硝酸与Au的物质的量为1:1,据此结合质量守恒定律写出反应的化学方程式为:Au+4HCl+HNO3=HAuCl4+NO↑+2H2O,
故答案为:Au+4HCl+HNO3=HAuCl4+NO↑+2H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,推断各元素为解答关键,注意熟练掌握原子结构与元素周期表结构、元素周期律内容之间关系,试题充分考查学生的分析、理解能力及灵活应用基础知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在试管中加入2mL10%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 | |
| B. | 将无水乙醇加热至170℃时,可以制得乙烯 | |
| C. | 用氢氧化钠溶液清洗盛过苯酚的试管 | |
| D. | 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素 |
 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
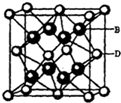 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
| A. | Fe(OH)3 | B. | Al(OH)3 | C. | HCl | D. | NaHCO3 |
| A. | 金刚石与石墨 | B. | T2O与H2O | C. | 40K与39K | D. | 16O与16O2- |