题目内容
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;C和B、E在周期表中均相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____________,D在周期表中的位置____________,E的离子结构示意图____________。
(2)B2分子的电子式:____________,A2C的结构式:____________,A2C2中的化学键类型有:____________(极性键、非极性键或离子键)。
(3)用电子式表示D2E化合物的形成过程为______。
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为________。
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是________(填序号)。
a 7.32L b 6.72L c 20.16L d 30.24L.
【答案】氢 第三周期IA族 ![]()
![]() H﹣O﹣H 极性键、非极性键
H﹣O﹣H 极性键、非极性键 ![]() CH4+4CuO
CH4+4CuO![]() 4Cu+CO2+2H2O ab
4Cu+CO2+2H2O ab
【解析】
A、B、C、D、E为原子序数依次增大的五种短周期主族元素,A单质是自然界中密度最小的气体,则A为H元素;A和D最外层电子数相同,则二者处于同族,原子序数相差大于2,则D处于第三周期,D为Na元素;结合原子序数可知B、C处于第二周期,E处于第三周期,C和B、E在周期表中相邻,且C、E同主族,B、C的最外层电子数之和等于D的原子核外电子数,B、C最外层电子数分别为5、6,故B为N元素,C为O元素,E为S元素,A和C可形成化合物H2O、H2O2。
(1)根据分析知,A元素的名称是氢;D为Na,在周期表中的位置是第三周期IA族;E的离子为S2-,结构示意图为![]() ;
;
(2)N2分子的电子式:![]() ;H2O的结构式:H﹣O﹣H;A2C2为H2O2,结构式为H﹣O﹣O﹣H,含有的化学键类型有:极性键、非极性键;
;H2O的结构式:H﹣O﹣H;A2C2为H2O2,结构式为H﹣O﹣O﹣H,含有的化学键类型有:极性键、非极性键;
(3)Na2S为离子化合物,用电子式表示形成过程为: ![]() ;
;
(4)A元素最简单的有机化合物为CH4,与赤热的氧化铜反应生成一种单质Cu、液态氧化物H2O和一可以使澄清石灰水变浑浊的气体CO2,其化学方程式为: CH4+4CuO![]() 4Cu+CO2+2H2O;
4Cu+CO2+2H2O;
(5)在100mL 18mol/L的浓H2SO4溶液中加入过量的铜片,加热使之充分反应,硫酸物质的量为0.1L×18mol/L=1.8mol,发生反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,假设浓硫酸完全反应,生成二氧化硫为0.9mol,但随着反应进行,浓硫酸变为稀硫酸,稀硫酸不与铜反应,故实际生成二氧化硫的体积小于0.9mol×22.4L/mol=20.16L,所以答案选ab。

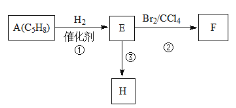
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%