题目内容
6.已知1~18号元素的离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列关系正确的是( )| A. | 元素原子失电子能力:X>W | B. | 离子的还原性:Z->Y2- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
分析 1~18号元素的离子W3+、X+、Y2-、Z-具有相同电子层结构,核外电子数相等,结合离子电荷可知,Y、Z为非金属,应处于第二周期,Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:1~18号元素的离子W3+、X+、Y2-、Z-具有相同电子层结构,核外电子数相等,结合离子电荷可知,Y、Z为非金属,应处于第二周期,Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素.
A.金属性Na>Al,故失去电子能力Na>Al,故A正确;
B.非金属性F>O,故离子的还原性:F-<O2-,故B错误;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HF>H2O,故C错误;
D.同周期随原子序数增大原子半径减小,故原子半径Na>Al,故D错误.
故选A.
点评 本题考查原子结构与元素周期律的相关知识,侧重对元素周期律的考查,难度不大,可以根据电子层结构确定在周期表中的位置关系,从而推断其性质,不需要确定具体的元素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在下列有关晶体的叙述中错误的是( )
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
17.对于NaHCO3与Na2CO3的性质,下列叙述错误的是( )
| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
14.AlCl3易溶于四氯化碳,加热到180℃升华.推测三氯化铝有可能属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
1.卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A. | 原子半径逐渐增大 | |
| B. | 单质熔、沸点逐渐降低 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 最高价氧化物的水化物的酸性逐渐增强 |
11.下列各组物质中,属于同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 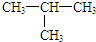 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
18.下列有关化学反应速率和限度的说法中,不正确的是( )
| A. | 实验室用H2O2制取O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水的反应中,增加水的量能加快反应速率 | |
| C. | 对于可逆反应来说,可以通过改变条件改变反应进行的限度 | |
| D. | 当一个可逆反应达到平衡状态时,就是该反应在该条件下所能达到的限度 |
15.合金的用途广泛.下列物质不属于合金的是( )
| A. | 水银 | B. | 青铜 | C. | 硬铝 | D. | 不锈钢 |
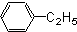 芳香烃,(7)
芳香烃,(7)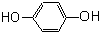 酚,(8)
酚,(8)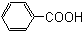 芳香酸.
芳香酸.