题目内容
在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化示意图如下:

(1)第二步反应是 反应(选填“放热”或“吸热”),判断依据是 。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的热化学方程式是 。

(1)第二步反应是 反应(选填“放热”或“吸热”),判断依据是 。
(2)1 mol NH4+ (aq)全部氧化成NO2- (aq)的热化学方程式是 。
(1)放热 ΔH=-73 kJ/mol(或反应的总能量大于生成物的总能量)
(2)NH4+(aq)+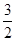 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
(2)NH4+(aq)+
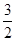 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol(1)由题意知,NH4+第一步氧化为NO2-,第二步NO2-氧化为NO3-,第二步反应中,反应物的总能量高于生成物的总能量,故第二步反应为放热反应。
(2)1 mol NH4+全部氧化成NO2-时,放出273 kJ的热量,则反应的热化学方程式为:NH4+ (aq)+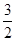 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。
O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。
(2)1 mol NH4+全部氧化成NO2-时,放出273 kJ的热量,则反应的热化学方程式为:NH4+ (aq)+
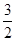 O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。
O2(g)=NO2- (aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol。
练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

 CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
 CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。