题目内容
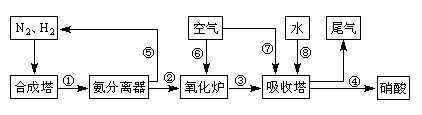
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
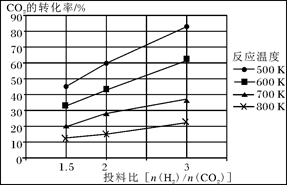
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)
 CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
(1)ΔH1+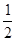 ΔH2-
ΔH2-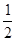 ΔH3
ΔH3
(2)①> ②350 1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失 ③AD
(3)0.125 mol·L-1·min-1 4 D
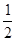 ΔH2-
ΔH2-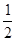 ΔH3
ΔH3(2)①> ②350 1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失 ③AD
(3)0.125 mol·L-1·min-1 4 D
(1)根据盖斯定律可得,ΔH=ΔH1+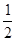 ΔH2-
ΔH2-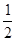 ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)
ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)  CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)
CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)  ?CO(g)+2H2(g)的
?CO(g)+2H2(g)的
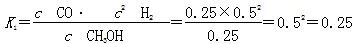
而反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
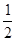 ΔH2-
ΔH2-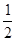 ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)
ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)  CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)
CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)  ?CO(g)+2H2(g)的
?CO(g)+2H2(g)的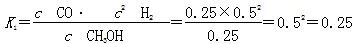
而反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)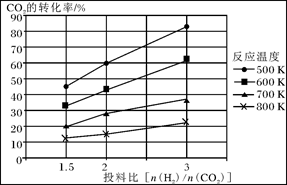
 CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1


 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。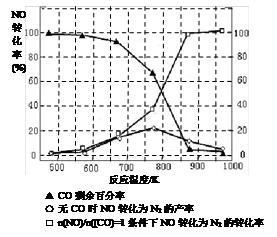
 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1 CO2(g) ΔH1<0①
CO2(g) ΔH1<0① CH3OH(g)。
CH3OH(g)。 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。