题目内容
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1367.0 kJ·mol-1(燃烧热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) |
| C.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
| D.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) |
D
本题考查热化学方程式的书写,意在考查考生对有关概念及化学用语的掌握情况。燃烧热必须是可燃物生成稳定的化合物对应的热效应,而气态水不是稳定的化合物,故A错误。中和反应是放热反应,ΔH<0,故B错误。书写热化学方程式时必须标明物质的状态,C错误。

练习册系列答案
相关题目
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1 
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。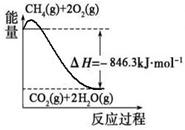
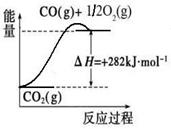
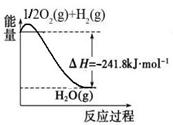
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0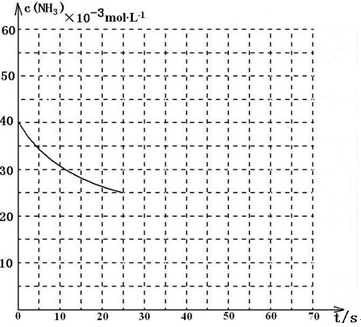
 CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据: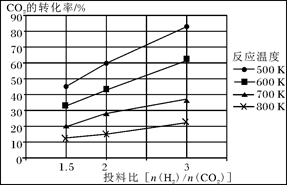
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)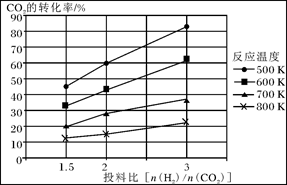
 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1 

 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1