题目内容
下列叙述不正确的是
| A.工业生产中常用生石灰来吸收废气中的二氧化硫 |
| B.二氧化硫的水溶液能使紫色石蕊试液变红,说明二氧化硫能与水反应生成酸 |
| C.二氧化硫能使有色物质颜色消失,说明二氧化硫具有氧化性 |
| D.二氧化硫能使酸性高锰酸钾溶液褪色,说明二氧化硫具有还原性 |
C
答案:C
C.不正确,二氧化硫能使有色物质颜色消失,说明二氧化硫具有漂白性,生成不稳定的无色物质。
A、正确,CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4
B、正确,SO2+H2O
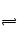 H2SO3
H2SO3D、正确,二氧化硫能使酸性高锰酸钾溶液褪色,SO2被氧化成SO42―.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
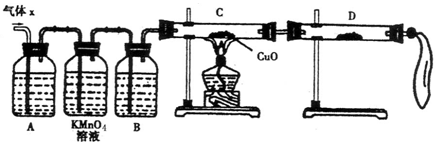
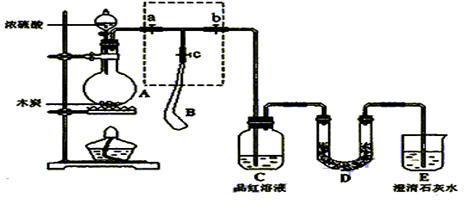 请回答下列问题:
请回答下列问题:  分的装置,则正确的操作
分的装置,则正确的操作