题目内容
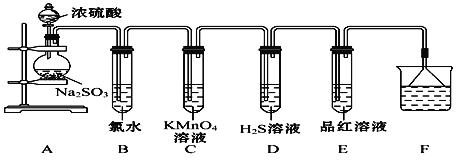
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。(已知:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O)
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。
(2)反应后,装置B中发生的现象是______________,反应的离子方程式为__________;装置C中的现象是__________,表现了SO2的__________________;装置D中的现象是__________,发生反应的化学方程式为__________________。
(3)装置E的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象________________________________________________________________
(4)F装置的作用是_________________________,倒扣漏斗的作用是__________
【答案】 分液漏斗 圆底烧瓶 溶液褪色 SO2+Cl2+2H2O4H++2Cl-+ SO42- 溶液紫色褪去(溶液褪色) 还原性 有黄色沉淀生成 2H2S+SO23S↓+2H2O 将试管E在酒精灯上加热,溶液恢复红色 吸收多余的SO2 防止倒吸
【解析】(1)根据仪器构造可判断,装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是分液漏斗、圆底烧瓶;(2)二氧化硫中硫元素是+4价,处于中间价态,既有还原性,又有氧化性,氯气为黄绿色的气体,其溶液为浅黄绿色,具有强氧化性,能氧化二氧化硫中+4价的硫,生成硫酸和盐酸,溶液褪色,反应方程式为SO2+Cl2+2H2O=4H++2Cl-+SO42-;酸性高锰酸钾有强氧化性,也能氧化二氧化硫中+4价的硫,所以二氧化硫能被酸性高锰酸钾溶液氧化而褪色,同时说明二氧化硫有还原性;硫化氢中的硫为-2价,与二氧化硫作用,二氧化硫表现为氧化性,被还原成0价的硫,反应方程式为2H2S+SO2=3S↓+2H2O;(3)二氧化硫具有漂白性,能使品红溶液褪色,但其漂白性不稳定,加热褪色后的品红溶液,溶液的颜色能复原,因此实验操作及现象为将试管E在酒精灯上加热,溶液恢复红色;(4)二氧化硫是大气污染物,需要尾气处理,则F装置的作用是吸收多余的SO2;1体积水中能溶解40体积的二氧化硫,倒扣的漏斗具有缓冲作用,能防止倒吸。

【题目】某学生用0.10molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为
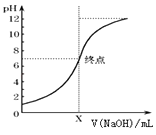
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH= , (含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定﹣﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 23.40 |
第二次 | 25.00 | 4.00 | 23.90 |
第三次 | 25.00 | 5.00 | 25.10 |
①滴定时,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为