题目内容
【题目】某学生用0.10molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH= , (含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定﹣﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 23.40 |
第二次 | 25.00 | 4.00 | 23.90 |
第三次 | 25.00 | 5.00 | 25.10 |
①滴定时,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为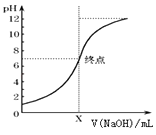
【答案】
(1)ADF
(2)10
(3)1+lg3;D
(4)锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色;0.2 mol/L
【解析】解:(1)A.滴定前平视读数,终点读数时仰视读数,导致消耗的标准液体积偏大,所测溶液浓度偏高,故A选; B.锥形瓶水洗后未用用标准盐酸润洗,使用操作正确,消耗的标准液体积准确,溶液浓度准确,故B不选;
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,导致待测液浓度变稀,消耗的标准液体积偏小,溶液浓度偏低,故不选;
D.标准液漏滴在锥形瓶外一滴,导致消耗的标准液体积偏大,溶液浓度偏高,故D选;
E.滴定前仰视读数,终点滴定后俯视读数,导致消耗的标准液体积偏小,溶液浓度偏低,故E不选;
F.碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗的标准液体积偏大,溶液浓度偏高,故F选;
故选:ADF;(2)终点时不慎多加了1滴NaOH溶液,即0.05mL,继续加水至50mL,反应后溶液中c(OH﹣)= ![]() ×0.1mol.L﹣1=10﹣4mol.L﹣1 ,
×0.1mol.L﹣1=10﹣4mol.L﹣1 ,
根据c(H+)c(OH﹣)=10﹣14 , 则c(H+)=10﹣10mol/L,pH=10,
所以答案是:10;(3)由溶液的pH变化图象起点可知,当还没加人氢氧化钠溶液时,此时pH=1,则C(HCl)=0.1mol/L,当滴加氢氧化钠溶液为10mL时,盐酸没反应完,此时溶液中C(H+)= ![]() =
= ![]() ,该混合液的pH=1+lg3.若用该氢氧化钠溶液滴定未知浓度的CH3COOH溶液,反应恰好完成时,生成醋酸钠,因为水解溶液呈碱性,所以只能选择酚酞作指示剂,故选:D;
,该混合液的pH=1+lg3.若用该氢氧化钠溶液滴定未知浓度的CH3COOH溶液,反应恰好完成时,生成醋酸钠,因为水解溶液呈碱性,所以只能选择酚酞作指示剂,故选:D;
所以答案是:pH=1+lg3; D;(4)①草酸溶液为无色,滴入高锰酸钾发生氧化还原反应,高锰酸根离子被还原,当加入最后一滴,溶液出现紫红色,且半分钟不褪色,说明草酸恰好反应完全,达到滴定终点;
所以答案是:锥形瓶中溶液由无色变为紫红色,且半分钟内不褪色;
②第一次滴定消耗标准液体积为:(23.40﹣0.50)mL=22.90mL,第二次滴定消耗标准液体积为:(23.90﹣4.00)mL=19.90mL,第三次滴定消耗标准液体积为:(25.10﹣5.00)mL=20.10mL,可见第一次数据误差较大,后2次滴定的数据都是有效的,消耗标准液的平均体积为:(19.90+20.10)÷2=
20.10mL,高锰酸钾的物质的量为:0.10mol/L×0.020L=0.0020mol,根据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,n(H2C2O4)= ![]() n(KMnO4)=0.005mol,
n(KMnO4)=0.005mol,
待测液草酸的物质的量浓度为: ![]() =0.2 molL﹣1 ,
=0.2 molL﹣1 ,
所以答案是:0.2 molL﹣1 .
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)![]() 2NH3(g) △H<0,相关数据如下表所示:
2NH3(g) △H<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | lmolN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol/L | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/mol/(L·min) | v甲 | v乙 | v丙 |
下列说法正确的是
A. V甲>V丙 B. K乙>K丙 C. c乙>c甲 D. V甲=V丙
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10