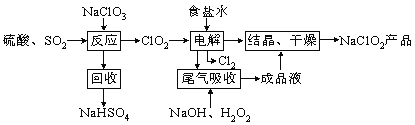
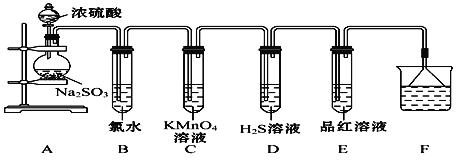
题目内容
【题目】向20 mL某浓度的AlCl3溶液中滴加2 molL-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示沉淀其物质的量是________
(2)反应至A点时消耗NaOH溶液的体积为_______
(3) AlCl3溶液的浓度为________
(4)假设溶液中有0. 39克Al(OH)3沉淀,则此时用去NaOH溶液体积为______
【答案】 0.01 mol 15 mL 0.5 mol L-1 7.5 mL或17.5mL
【解析】(1)AlCl3溶液中滴加2 molL-1的NaOH溶液生成氢氧化铝沉淀,图中A点表示沉淀的化学式是Al(OH)3,其物质的量是0.78g÷78mol=0.01mol。(2)根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl可知反应至A点时消耗NaOH溶液的体积为![]() =0.015L=15mL。(3)根据方程式可知AlCl3溶液的浓度为0.01mol÷0.02L=0.5mol L-1。(4)假设溶液中有0.39克即0.005molAl(OH)3沉淀,如果铝离子过量,根据方程式Al3++3OH-=Al(OH)3↓可知消耗氢氧化钠是0.015mol,体积是0.015mol÷2mol/L=0.0075L=7.5mL;如果生成的氢氧化铝部分溶解,根据铝原子守恒可知生成的偏铝酸钠是0.005mol,所以反应的方程式应该是2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O,则此时用去NaOH的物质的量为0.035mol,对应NaOH溶液体积为0.035mol÷2 molL-1=0.0175L=17.5mL。
=0.015L=15mL。(3)根据方程式可知AlCl3溶液的浓度为0.01mol÷0.02L=0.5mol L-1。(4)假设溶液中有0.39克即0.005molAl(OH)3沉淀,如果铝离子过量,根据方程式Al3++3OH-=Al(OH)3↓可知消耗氢氧化钠是0.015mol,体积是0.015mol÷2mol/L=0.0075L=7.5mL;如果生成的氢氧化铝部分溶解,根据铝原子守恒可知生成的偏铝酸钠是0.005mol,所以反应的方程式应该是2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O,则此时用去NaOH的物质的量为0.035mol,对应NaOH溶液体积为0.035mol÷2 molL-1=0.0175L=17.5mL。

练习册系列答案
相关题目