��Ŀ����
����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ����������Ʊ�ϩ���������ľ��ü�ֵ��������塣�ش��������⣺
��1����֪��I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ��mol-1
II.2H2(g)+O2(g)=2H2O(g) H=-484kJ��mol-1
����������Ʊ�ϩ��ӦC3H8(g)![]() C3H6(g)+H2(g)��HΪ__��
C3H6(g)+H2(g)��HΪ__��
��2��һ���¶��£�������ܱ������г���1molC3H8����ʼѹǿΪpkPa���������������Ʊ�ϩ��Ӧ��
�����������˵�����������Ʊ�ϩ��Ӧ�ﵽƽ��״̬����__(����ĸ)��
A. �÷�Ӧ���ʱ�(H)���ֲ���
B. ����ƽ��Ħ���������ֲ���
C. �����ܶȱ��ֲ���
D. C3H8�ֽ�������C3H6�����������
�ڱ��������Ʊ�ϩ��Ӧ�����У�C3H8��������������뷴Ӧʱ��Ĺ�ϵ��ͼa��ʾ�����¶��¸÷�Ӧ��ƽ�ⳣ��Kp=__kPa(�ú���ĸp�Ĵ���ʽ��ʾ��Kp���÷�Ӧ��ϵ���������ʵķ�ѹ��ʾ��ƽ�ⳣ����ƽ���ѹ=��ѹ�����ʵ�������)��
����֪������Ӧ�У�v��=k����p(C3H8)��v��=k����p(C3H6)p(H2)������k����k��Ϊ���ʳ�����ֻ���¶��йأ���ͼa��m�㴦![]() =_��
=_��
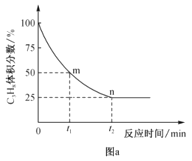
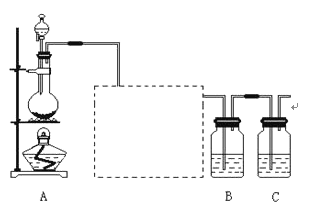
��3��������ͬ��Ӧʱ�䣬�ڲ�ͬ�¶��£���ϩ������ͼb��ʾ����ϩ������425��֮ǰ���¶����߶������ԭ�������__��__��425��֮��ϩ���ʿ��ٽ��͵���Ҫԭ�������__��
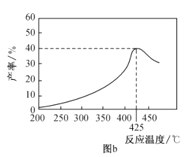
���𰸡�+123kJ/mol BD 0.9P 5.4 �¶����߷�Ӧ���ʼӿ� �����¶������ڷ�Ӧ�����ȷ������ ����ʧ������Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������
��������
(1)������֪�Ȼ�ѧ����ʽ��˹���ɽ��м��㣻
(2)���������ݻ����䣬�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ���ﵽ��ѧƽ��״̬ʱ���淴Ӧ������ȣ������ʵ�����Ũ�ȵȱ��ֲ��䣬�Լ�����������һЩ��Ҳ���䣬��һ���������仯�����������ˣ��ſ���Ϊ�ж�ƽ��ı�־��
C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ���ﵽ��ѧƽ��״̬ʱ���淴Ӧ������ȣ������ʵ�����Ũ�ȵȱ��ֲ��䣬�Լ�����������һЩ��Ҳ���䣬��һ���������仯�����������ˣ��ſ���Ϊ�ж�ƽ��ı�־��
�ڸ��ݴﵽƽ��ʱ��������������Ϊ25%���г�����ʽ����ƽ��ʱ����������ʵ������������������ѹ���ټ���Kp��
���ȸ��ݵ���Ӧ�ﵽƽ��ʱ��v��=v������k����p(C3H8)= k����p(C3H6)p(H2)������![]() ���ٸ���m�㴦��������������Ϊ50%���г�����ʽ�����ʱ����������ʵ����������ټ����ѹ����������
���ٸ���m�㴦��������������Ϊ50%���г�����ʽ�����ʱ����������ʵ����������ټ����ѹ����������![]() ��
��
(3)�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ�����ͼ��������¶ȶԷ�Ӧ���ʺ�ƽ�⡢�����ȵ�Ӱ����з�����
C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ�����ͼ��������¶ȶԷ�Ӧ���ʺ�ƽ�⡢�����ȵ�Ӱ����з�����
(1)��֪�Ȼ�ѧ����ʽ��I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) H=-238kJ��mol-1��II.2H2(g)+O2(g)=2H2O(g) H=-484kJ��mol-1�����ݸ�˹���ɿ�֪��![]() (I-II)�ɵ�Ŀ�귽��ʽC3H8(g)
(I-II)�ɵ�Ŀ�귽��ʽC3H8(g)![]() C3H6(g)+H2(g)����
C3H6(g)+H2(g)����![]() ���ʴ�Ϊ��+123kJ/mol��
���ʴ�Ϊ��+123kJ/mol��
(2)���������ݻ����䣬�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ��
C3H6(g)+H2(g)������ӦΪ�������ʵ�������ķ�Ӧ��
A. �÷�Ӧ���ʱ�(H)Ϊһ��ֵ�����۷�Ӧ�Ƿ�ﵽƽ�⣬ʼ�ձ��ֲ��䣬��÷�Ӧ���ʱ�(H)���ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����A�����ϣ�
B. �����������������䣬���ŷ�Ӧ�Ľ��У��������ʵ�������������ƽ��Ħ���������С��������ƽ��Ħ���������ֲ���ʱ����˵����Ӧ�ﵽƽ��״̬����B���ϣ�
C. �����������������䣬�������ݻ����䣬�������ܶ�Ϊһ��ֵ��ʼ�ձ��ֲ��䣬�������ܶȱ��ֲ��䣬����˵����Ӧ�ﵽƽ��״̬����C�����ϣ�
D. C3H8�ķֽ�����Ϊ����Ӧ���ʣ�C3H6����������Ϊ�淴Ӧ���ʣ�������ȣ���C3H8�ķֽ�������C3H8������������ȣ�˵�����淴Ӧ������ȣ���˵����Ӧ�ﵽƽ��״̬����D���ϣ��ʴ�Ϊ��BD��
����ͼ��֪�ﵽƽ��ʱ��������������Ϊ25%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
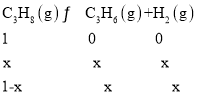 ���������������Ϊ
���������������Ϊ![]() �����x=0.6����ƽ��ʱ���������ʵ���Ϊ1.6mol�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã�ƽ��ʱ���������ѹǿΪ1.6pkPa����ϩ�����ʵ������������������ʵ���������Ϊ
�����x=0.6����ƽ��ʱ���������ʵ���Ϊ1.6mol�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã�ƽ��ʱ���������ѹǿΪ1.6pkPa����ϩ�����ʵ������������������ʵ���������Ϊ![]() ����p(C3H8)=
����p(C3H8)=![]() ��p(C3H6)=p(H2)=
��p(C3H6)=p(H2)=![]() ����
����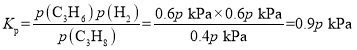 ��
��
�ʴ�Ϊ��0.9P��
�۵���Ӧ�ﵽƽ��ʱ��v��=v������k����p(C3H8)= k����p(C3H6)p(H2)����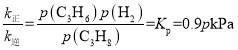 ��m�㴦��������������Ϊ50%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
��m�㴦��������������Ϊ50%��������ת����Ϊxmol�����г�����ʽ����λΪ��mol����
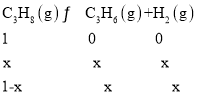 ���������������Ϊ
���������������Ϊ![]() �����x=
�����x=![]() �����ʱ���������ʵ���Ϊ
�����ʱ���������ʵ���Ϊ![]() �����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã���ʱ�������ѹǿΪ
�����ݺ��º���ʱ��ѹǿ֮�ȵ������ʵ���֮�ȿɵã���ʱ�������ѹǿΪ![]() ����ϩ�����ʵ������������������ʵ���������Ϊ
����ϩ�����ʵ������������������ʵ���������Ϊ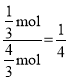 ����p(C3H8)=
����p(C3H8)=![]() ��p(C3H6)=p(H2)=
��p(C3H6)=p(H2)=![]() ����
����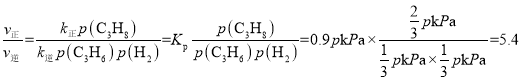 ���ʴ�Ϊ��5.4��
���ʴ�Ϊ��5.4��
(3)�÷�ӦC3H8(g)![]() C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ��������ͬ��Ӧʱ�䣬425��֮ǰ���¶�Խ�߷�Ӧ����Խ�죬�¶�Խ�ߣ�ƽ�������ƶ��̶�Խ��ϩ����Խ��425��֮��ϩ���ʿ��ٽ��ͣ��������¶ȹ��ߣ����´���ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������ʴ�Ϊ���¶����߷�Ӧ���ʼӿ죻�����¶������ڷ�Ӧ�����ȷ�����У�����ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ���������
C3H6(g)+H2(g)������ӦΪ���ȷ�Ӧ��������ͬ��Ӧʱ�䣬425��֮ǰ���¶�Խ�߷�Ӧ����Խ�죬�¶�Խ�ߣ�ƽ�������ƶ��̶�Խ��ϩ����Խ��425��֮��ϩ���ʿ��ٽ��ͣ��������¶ȹ��ߣ����´���ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ����������ʴ�Ϊ���¶����߷�Ӧ���ʼӿ죻�����¶������ڷ�Ӧ�����ȷ�����У�����ʧ���Ӧ����Ѹ�ټ�С���߷�������Ӧ������ֽ���������