题目内容
【题目】在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____(填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
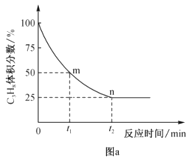
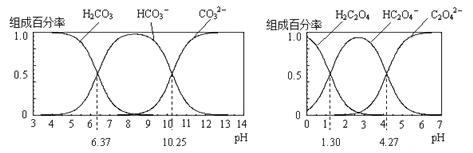
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1 ℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______。
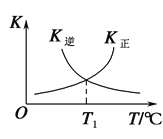
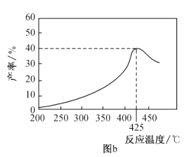
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g) ![]() 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
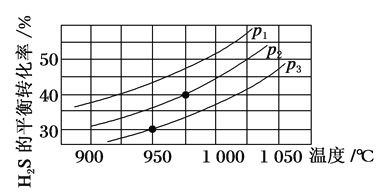
(4)图中压强p1、p2、p3由大到小的顺序是______。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____(保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___MPa。
【答案】-40kJ·mol-1 D 33.3% p3>p2>p1 0.0025mol·(L·min)-1 0.022mol·L-1 ![]()
【解析】
(1)根据盖斯定律,由反应①-反应②得CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=ΔH1-ΔH2=-94 kJ·mol-1-(-54 kJ·mol-1)=-40 kJ·mol-1;
H2(g)+CO2(g) ΔH=ΔH1-ΔH2=-94 kJ·mol-1-(-54 kJ·mol-1)=-40 kJ·mol-1;
(2)A. 反应①为反应前后气体分子数不变的反应,容器容积不变,压强始终保持不变,根据压强不能判断反应是否达到平衡状态,故A错误;
B. 该反应的反应物和生成物均为气体,且容器容积不变,则混合气体的密度始终保持不变,据此不能判断反应是否达到平衡状态,故B错误;
C. 化学平衡常数只受温度影响,由于温度不变,不能由此判断反应是否达到平衡状态,故C错误;
D. 生成1 mol H—O键,同时生成1 mol H—S键,说明反应物的消耗速率等于生成物的消耗速率,也即正反应速率与逆反应速率相等,说明反应达到平衡状态,故D正确;
(3)设反应达到平衡时,转化的COS的物质的量为x mol,根据反应方程式COS(g)+H2(g)![]() H2S(g)+CO(g)可知平衡时COS(g)、H2(g)、H2S(g)、CO(g)的物质的量分别为(2-x) mol、(1-x) mol、x mol、x mol,容器的体积为5L,根据T1 ℃时有K正=K逆得
H2S(g)+CO(g)可知平衡时COS(g)、H2(g)、H2S(g)、CO(g)的物质的量分别为(2-x) mol、(1-x) mol、x mol、x mol,容器的体积为5L,根据T1 ℃时有K正=K逆得 ,解得x=
,解得x=![]() mol,则COS的平衡转化率为
mol,则COS的平衡转化率为![]() ×100%=33.3%;
×100%=33.3%;
(4)该反应为气体分子数增大的反应,温度一定时,压强越小,H2S的平衡转化率越高,故压强p3>p2>p1;
(5)根据题图2可看出在950 ℃,压强为p3时,H2S的平衡转化率为30%,即反应的H2S的物质的量为0.5 mol×30%=0.15 mol,由于化学方程式中H2S和H2的化学计量数相同,则v(H2)=v(H2S)= =0.002 5 mol·(L·min)-1;
=0.002 5 mol·(L·min)-1;
(6)根据题图2可知压强为p2、温度为975 ℃时,H2S的平衡转化率为40%,即分解的H2S为0.5 mol×40%=0.2 mol,根据方程式2H2S(g)![]()
![]() 2H2(g)+S2(g)可知生成的n(S2)=0.1mol,n(H2)=0.2mol,剩余的n(H2S)=0.3mol,容器的体积为2L,所以平衡时H2S(g)、H2(g)、S2(g)的物质的量浓度分别为0.15 mol·L-1、0.10 mol·L-1和0.05 mol·L-1,则Kc=
2H2(g)+S2(g)可知生成的n(S2)=0.1mol,n(H2)=0.2mol,剩余的n(H2S)=0.3mol,容器的体积为2L,所以平衡时H2S(g)、H2(g)、S2(g)的物质的量浓度分别为0.15 mol·L-1、0.10 mol·L-1和0.05 mol·L-1,则Kc=![]() mol·L-1≈0.022 mol·L-1。平衡时H2S(g)、H2(g)、S2(g)的物质的量分别为0.3 mol、0.2 mol和0.1 mol,即对应的平衡分压分别为
mol·L-1≈0.022 mol·L-1。平衡时H2S(g)、H2(g)、S2(g)的物质的量分别为0.3 mol、0.2 mol和0.1 mol,即对应的平衡分压分别为![]() p2、
p2、![]() p2、
p2、![]() p2,则此时对应的Kp=
p2,则此时对应的Kp= 。
。