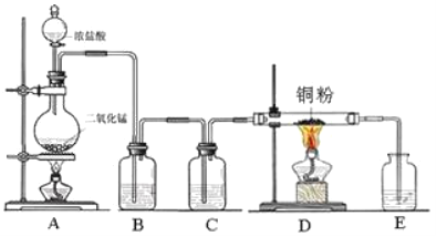
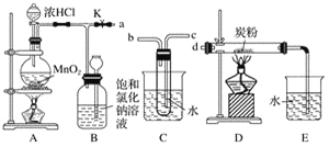
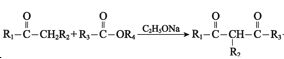
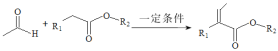
题目内容
【题目】![]() ,改变
,改变![]() 溶液的
溶液的![]() ,溶液中
,溶液中![]() 浓度的对数值
浓度的对数值![]() 与溶液
与溶液![]() 的变化关系如图所示。若
的变化关系如图所示。若![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
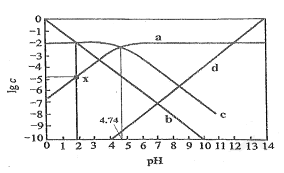
A. ![]() 时,
时,![]()
B. ![]() 电离常数的数量级为
电离常数的数量级为![]()
C. 图中点x的纵坐标值为![]()
D. ![]() 的
的![]() 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值
【答案】A
【解析】
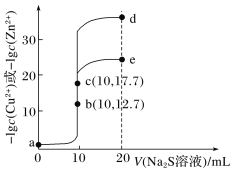
根据图知,pH<7时,CH3COOH电离量少,c表示CH3COOH的浓度;pH=7时c(OH-)=c(H+),二者的对数相等,且pH越大c(OH-)越大、c(H+)越小,则lgc(OH-)增大,所以b、d分别表示H+、OH-;pH>7时,CH3COOH几乎以CH3COO-形式存在,a表示CH3COO-;
A、pH=6时,纵坐标越大,该微粒浓度越大;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+);
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
A、pH=6时,纵坐标越大,该微粒浓度越大,所以存在c(CH3COO-)>c(CH3COOH)>c(H+),故A错误;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+)=10-4.74,故B正确;
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;pH=2时,c(H+)=10-2mol·L-1,从曲线c读出c(CH3COOH)=10-2mol·L-1,由选项B,K=10-4.74,解得c(CH3COO-)=10-4.74,故C正确;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
故选A。

【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1) 在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有________________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____________。
(4) ③、⑤、⑦、⑧形成的离子,其半径由小到大的顺序是________(填离子符号)
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式),呈两性的氢氧化物是_________(填物质化学式);该化合物与NaOH溶液反应的离子方程式为___________。
(6) 用电子式表示元素③与⑨形成化合物的过程_____________________________。
(7)写出工业冶炼⑤的化学方程式:_______________________________________。