题目内容
18.X、Y、Z、M四种短周期元素的原子半径依次减小.甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的$\frac{2}{3}$;乙是日常生活的基础能源,其中含元素Y的质量分数为75%;丙是具有强氧化性的弱酸.丁为丙的钠盐,常用于漂白或消毒.戊与甲的组成元素相同,其分子具有18电子.请按要求回答下列问题:(1)元素X、Y的最高价氧化物的水化物的酸性由强到弱为(填化学式)HClO4>H2CO3;丁的电子式为
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.(2)元素E、F与X同周期.
①常温下E的单质与甲反应缓慢,加热至沸腾反应迅速,滴加酚酞试液,溶液变红色;此反应的化学方程式为Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑.
②F的单质粉末加油漆后即得“银粉漆”,在汽车漆家族中有重要地位.写出保存“银粉”时的注意事项:密封、避免与酸或碱接触等.
(3)向盛有一定浓度戊溶液的烧杯中逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中可依次观察到的现象:
a.浅绿色溶液变成黄色
b.有少量气泡产生,片刻后反应变得更剧烈,并放出较多热量
c.继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀
①现象a中反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;
②现象b中反应剧烈的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
③解释现象c:起始反应即①中使c(H+)降低,且反应②放热,使Fe3++3H2O?Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
分析 X、Y、Z、M四种短周期元素的原子半径依次减小.甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3,甲为水,可推知M为H元素;丙是具有强氧化性的弱酸,则丙为HClO,乙是日常生活的基础能源,其中含元素Y的质量分数为75%,乙为甲烷,可推知X为Cl、Y为C元素、Z为O元素;丁为丙的钠盐,常用于漂白或消毒,则丁为NaClO;戊与甲的组成元素相同,其分子具有18电子,则戊为H2O2,据此进行解答.
解答 解:X、Y、Z、M四种短周期元素的原子半径依次减小.甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3,甲为水,可推知M为H元素;丙是具有强氧化性的弱酸,则丙为HClO,乙是日常生活的基础能源,其中含元素Y的质量分数为75%,乙为甲烷,可推知X为Cl、Y为C元素、Z为O元素;丁为丙的钠盐,常用于漂白或消毒,则丁为NaClO;戊与甲的组成元素相同,其分子具有18电子,则戊为H2O2.
(1)元素X、Y的最高价氧化物的水化物分别为:HClO4、H2CO3,非金属性Cl>C,故酸性由强到弱为HClO4>H2CO3;丁为NaClO,电子式为  ;与甲(水)分子具有相同电子数且含元素种类相同的离子有:OH-、H3O+,
;与甲(水)分子具有相同电子数且含元素种类相同的离子有:OH-、H3O+,
故答案为:HClO4>H2CO3; ;OH-;H3O+;
;OH-;H3O+;
(2)元素E、F与X(Cl)同周期.
①常温下E的单质与甲反应缓慢,加热至沸反应迅速,滴加酚酞试液,溶液变红色,则E为Mg,此反应的化学方程式为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
故答案为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
②F的单质粉末加油漆后即得“银粉漆”,则F为Al,易与氧气反应,与酸、碱反应,保存“银粉”时的注意密封、避免与酸或碱接触;
故答案为:密封;避免与酸或碱接触;
(3)①过氧化氢具有强氧化性,将亚铁离子氧化为铁离子,反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②过氧化氢在铁离子作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2O2↑,
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
③起始反应即①中使c(H+)降低,且反应②放热,使Fe3++3H2O?Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀,
故答案为:起始反应即①中使c(H+)降低,且反应②放热,使Fe3++3H2O?Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
点评 本题考查元素化合物推断,是对学生综合能力的考查,题目难度中等,涉及元素的推断、物质的电子式、化学式的书写、物质的保存方法、盐的水解及反应现象的描述的知识,需要学生熟练掌握元素化合物知识.

 阅读快车系列答案
阅读快车系列答案| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
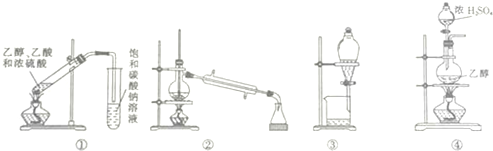
| A. | 装置①可用于实验室制取乙酸乙酯 | |
| B. | 装置②可用于分离苯和甲苯 | |
| C. | 装置③可用于分离碘的四氯化碳溶液 | |
| D. | 装置④可用于实验室制取乙烯 |
| A. | 简单立方 | B. | 钾型 | C. | 镁型 | D. | 铜型 |
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有Na+的物质的量为0.1mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | 标准状况下,22.4 L盐酸含有NA个HCl分子 |
| A. | 10 g H2和10 g O2 | B. | 5.6 L N2(标准状况)和22 g CO2 | ||
| C. | 9 g H2O和0.5 mol Br2 | D. | 224 mL H2和0.01 mol N2 |
| A. | Fe2O3是还原剂 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | 反应中转移3个电子 |
| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |