题目内容
8.烟气中NOx是NO和NO2的混合物(不含N2O4).(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO0.25L(标准状况,保留2位小数).
(2)若用氨气除去废气中的氮氧化物(NOx):NOx+NH3→N2+H2O(l).假如每升废气中含NOx0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况).
①NOx中的 x 值为1.2(保留1位小数).
②除去废气中的NOx,至少需氨0.24mol(保留2位小数).
(3)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为1.64mol/L(保留2位小数).
(4)已知:NO+NO2+Na2CO3→2NaNO2+CO2 ①
2NO2+Na2CO3→NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气不符合排放标准(填“符合”或“不符合”),
理由:吸收后烟气总体积减小,NOx含量仍超过400mg/m3.
分析 (1)根据NO的质量分数计算NO的质量,在根据n=$\frac{m}{M}$计算NO的物质的量,根V=nVm计算NO的体积;
(2)100L的废气中有NOx物质的量为:$\frac{100×0.0672L}{22.4L/mol}$=0.3mol,物质的量减少:$\frac{(110-103.952)L}{22.4L/mol}$=0.27mol,
设混合气体中NO物质的量为x,NO2的物质的量为y,根据化合价升降配平方程式xNO+yNO2+$\frac{2x+4y}{3}$NH3→$\frac{x+y+\frac{2x+4y}{3}}{2}$N2+(x+2y)H2O(l),
根据混合气体中NO和NO2的物质的量之和为0.3mol、物质的量减少:x+y+$\frac{2x+4y}{3}$-$\frac{x+y+\frac{2x+4y}{3}}{2}$=0.27,求出x、y,然后进行计算;
(3)根据c=$\frac{1000ω}{M}$计算碳酸钠溶液物质的量浓度;
(4)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3.
解答 解:(1)lm3烟气中含有的NO的最大质量为:400mg×0.85=340mg,标况下340mgNO的体积为:$\frac{0.34g}{30g/mol}$×22.4L/mol=0.25L,
故答案为:0.25;
(2)100L的废气中有NOx物质的量为:$\frac{100×0.0672L}{22.4L/mol}$=0.3mol,物质的量减少:$\frac{(110-103.952)L}{22.4L/mol}$=0.27mol,
设混合气体中NO物质的量为x,NO2的物质的量为y,根据化合价升降配平方程式xNO+yNO2+$\frac{2x+4y}{3}$NH3→$\frac{x+y+\frac{2x+4y}{3}}{2}$N2+(x+2y)H2O(l),
根据混合气体中NO和NO2的物质的量之和为0.3mol、物质的量减少:x+y+$\frac{2x+4y}{3}$-$\frac{x+y+\frac{2x+4y}{3}}{2}$=0.27(化简 5x+7y=1.62),
混合气体:x+y=0.3
解得:x=0.24,y=0.06,
所以转移的电子数:0.24×2+0.06×4=0.72mol,
将xy数据带入可得:0.24NO+0.06NO2+0.24NH3=0.27N2+0.48H2O 化简得:8NO+2NO2+8NH3=9N2+16H2O,
①根据8NO+2NO2+8NH3=9N2+16H2O,可以知道N为10,O为12,所以为NO1.2,即x=1.2,
故答案为:1.2;
②根据8NO+2NO2+8NH3=9N2+16H2O可知,除去废气中的NOx至少需要氨气与NO物质的量相等,为0.24molNH3,
故答案为:0.24;
(3)该碳酸钠溶液物质的量浓度为:$\frac{1000×1.16×0.15}{106}$mol/L=1.64mol/L,故答案为:1.64;
(4)未被被吸收的NOx的质量为:2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3,故不符合,
故答案为:不符合;吸收后烟气总体积减小,NOx含量仍超过400mg/m3.
点评 本题以环境保护为信息来考查学生对氧化还原反应的分析,题目难度中等.明确元素化合价的变化及电子守恒来配平化学反应是解答本题的关键,注重了化学与生活的联系,符合高考的导向.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 1H、2H、H+都可说成是氢元素的不同微粒 | |
| B. | 16O2和18O2互为同位素,化学性质相同 | |
| C. | 铝原子的结构示意图: | |
| D. | 甲烷的结构式:CH4 |
| A. | NaF | B. | MgI2 | C. | NaI | D. | KBr |
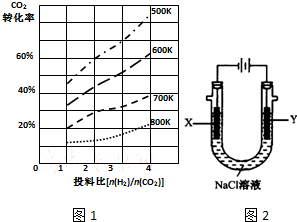 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.