题目内容
3.使用如图所示装置进行化学小实验,请填写下列空白;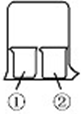
(1)若①中放一片湿润的红色石蕊试纸,
②装有浓氨水,可观察到的实验现象是:①中湿润的红色石蕊试纸变蓝色.
(2)若①装有AlCl3溶液,②装有浓氨水,可观察到的实验现象为①中出现白色沉淀,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 (1)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨水溶液中电离出氢氧根离子和铵根离子;
(2)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀.
解答 解:(1)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨水溶液中电离出氢氧根离子和铵根离子,溶液显碱性,①中湿润的红色石蕊试纸变蓝色;
故答案为:①中湿润的红色石蕊试纸变蓝色;
(2)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:①中出现白色沉淀;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查了浓氨水的性质分析,氨气溶于水形成弱碱,和氯化铝反应生成氢氧化铝沉淀,题目较简单.

练习册系列答案
相关题目
7.含有下列各组离子的溶液中,通入NH3后仍能大量共存的是( )
| A. | H+、Cu2+、Fe3+、SO42- | B. | Na+、Ba2+、Al3+、Cl- | ||
| C. | K+、Ag+、NH4+、NO3- | D. | Na+、K+、Br-、OH- |
14.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
11.下列说法正确的是( )
| A. | 离子化合物中可能含有共价键,但不一定含有金属元素 | |
| B. | 分子中一定含有共价键 | |
| C. | 非极性分子中一定存在非极性键 | |
| D. | 极性分子中一定不存在非极性键 |
18.1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为( )
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
12.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍为10L.下列各组混合烃中不符合此条件的是( )
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H4 | D. | CH4、C3H4 |
13.A、B、C是三种金属,根据下列两个实验,确定它们的还原性强弱顺序为①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)( )
| A. | A>B>C | B. | B>C>A | C. | C>A>B | D. | B>A>C |
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.