题目内容
19.回答有关以通式CnH2n+1OH所表示的一元醇的下列问题:(1)出现同分异构体的最小n值是3.
(2)n=4的同分异构体中,氧化后能生成醛的醇有2个,它们的结构简式是CH3CH2CH2CH2OH,
(CH3)2CHCH2OH.
(3)具有同分异构体的醇和浓硫酸加热时,只能得到一种不饱和烃(烯烃类),符合这一结果的醇的n值为3.
分析 (1)CnH2n+1OH所表示的一元醇,有碳链异构和位置异构;
(2)能氧化成醛的醇的结构中必须含-CH2OH基团;
(3)当n<3时,此醇无同类的同分异构体,当n>3时,发生消去反应时,得到的消去产物的种类不一定相同,据此分析.
解答 解:(1)-CH3、-C2H5均只有1种,-C3H7有2种,故出现醇类同分异构体从n=3开始,有1-丙醇、2-丙醇之分,故答案为:3;
(2)n=4的同分异构体中,碳链异构有2种,而能氧化成醛的醇的结构中必须含-CH2OH基团,即必须-OH连在碳链的端点碳上,这样的醇有2种:CH3CH2CH2CH2OH,
(CH3)2CHCH2OH,故答案为:2,CH3CH2CH2CH2OH,(CH3)2CHCH2OH;
(3)3.当n>3时,醇发生消去反应所得的烯烃具有同分异构体,如n=4时,生成的烯烃有三种:CH3CH2CH=CH2、CH3CH=CHCH3和CH3CH2CH=CH2和(CH3)2CH=CH2,故要使此醇又具有同分异构体,消去反应后产物只有一种,则n的值应为3.故答案为:3.
点评 本题考查了有关醇的结构的推导,应注意的是能氧化成醛的醇的结构中必须含-CH2OH基团,即必须-OH连在碳链的端点碳上.

练习册系列答案
相关题目
1.已知反应:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
那么在相同温度下反应:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的焓变为( )
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1
②$\frac{1}{2}$N2(g)+O2(g)═NO2(g)△H2
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H3
那么在相同温度下反应:4NH3(g)+7O2(g)═4NO2(g)+6H2O(g)的焓变为( )
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
7.下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)化学性质最不活泼的元素是?Ne(填元素符号).
(2)镁的原子结构示意图为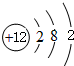 .
.
(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)镁的原子结构示意图为
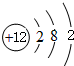 .
.(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
14.已知$\frac{1}{2}$H2(g)+$\frac{1}{2}$C12(g)═HCl(g);△H=-92.3kJ•mol-1,则反应2HCl(g)═H2(g)+Cl2(g)的△H为( )
| A. | +92.3 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | -184.6 kJ•mol-1 | D. | +184.6 kJ•mol-1 |
4.下列说法正确的是( )
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
11.下列物质中,含离子键和非极性共价键的是( )
| A. | H2O2 | B. | Na2O2 | C. | H2S | D. | Mg(NO3)2 |
8.下列关于铜-锌-稀H2SO4构成的原电池的有关叙述,错误的是( )
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,铜不易失去电子而受到保护 | |
| C. | 外电路电子流入的一极为正极电子流出的一极为负极 | |
| D. | 负极发生还原反应,正极发生氧化反应 |
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.