题目内容
1.在2L密闭容器中,把2mol X和2mol Y混合,发生如下反应:3X(g)+Y(g)═nP(g)+2Q(g),当反应经2min达到平衡,测得P的浓度为0.8mol/L,Q的浓度为0.4mol/L,则下列判断中,不正确的是( )| A. | n=4 | |
| B. | X的转化率为60% | |
| C. | X的平衡浓度为0.4mol/L | |
| D. | 2 min内Y的平均速率为0.4mol/(L.min) |
分析 在2L密闭容器中,把2mol X和2mol Y混合,当反应经2min达到平衡,测得Q的浓度为0.4mol/L,Q的物质的量为0.4mol/L×2L=0.8mol,则:
3X(g)+Y(g)═nP(g)+2Q(g)
起始量(mol):2 1 0 0
变化量(mol):1.2 0.4 0.4n 0.8
平衡量(mol):0.8 0.6 0.4n 0.8
A.根据P的计算计算n的值;
B.X的转化率=$\frac{消耗的X的物质的量}{X起始物质的量}$×100%;
C.根据c=$\frac{n}{V}$计算X的平衡浓度;
D.根据v=$\frac{△c}{△t}$计算v(Y).
解答 解:在2L密闭容器中,把2mol X和2mol Y混合,当反应经2min达到平衡,测得Q的浓度为0.4mol/L,Q的物质的量为0.4mol/L×2L=0.8mol,则:
3X(g)+Y(g)═nP(g)+2Q(g)
起始量(mol):2 1 0 0
变化量(mol):1.2 0.4 0.4n 0.8
平衡量(mol):0.8 0.6 0.4n 0.8
A.平衡时P的浓度为0.8mol/L,则0.4n mol=2L×0.8mol/L,解得n=4,故A正确;
B.平衡时X的转化率=$\frac{1.2mol}{2mol}$×100%=60%,故B正确;
C.X的平衡浓度为$\frac{0.8mol}{2L}$=0.4mol/L,故C正确;
D.2 min内Y的平均速率v(Y)=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol/(L.min),故D错误,
故选:D.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意掌握三段式解题法在化学平衡计算中应用.

| A. | 制取气体:先检验装置的气密性,后加入药品 | |
| B. | 点燃可燃性气体:先检验气体的纯度,后点燃 | |
| C. | CO还原氧化铁实验结束时:先停止通CO,后撤离酒精灯停止加热 | |
| D. | 除去H2中混有的CO2和H2O蒸汽,先通过氢氧化钠溶液,后通过浓硫酸 |
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu.
| A. | CuCl2>FeCl2>FeCl3 | B. | FeCl3>FeCl2>CuCl2 | ||
| C. | CuCl2>FeCl3>FeCl2 | D. | FeCl3>CuCl2>FeCl2 |
(1)将1L混合气体充分燃烧,在同温同压下得到2.5LCO2气体.试通过计算推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比(VA:VB) |
| ① | |||
| ② | |||
| ③ | |||
| ④ |
(2)120℃时,取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大了6.25%.试通过计算确定唯一符合题意的A、B的分子式C2H6、C4H8.
| A. | 5mol | B. | 10mol | C. | 20mol | D. | 30mol |
| A. | 12753I和12953I2互为同位素 | |
| B. | NH5的电子式为  | |
| C. | 氯原子的结构示意图: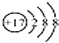 | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
| A. | 23 | B. | 46 | C. | 69 | D. | 92 |