题目内容
 (2012?南通模拟)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
(2012?南通模拟)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )分析:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量,进而表示出A的体积分数,据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、根据平衡时C的物质的量,利用三段式计算出平衡时各组分的物质的量,进而计算平衡常数.再通入0.36 molA时,假定平衡不移动,恒温恒压下,体积之比等于物质的量之比,据此计算通入0.36 molA时瞬间体积,再计算各物质的量的浓度,进而计算浓度商,与平衡常数比较,判断平衡移动,据此确定.
A、让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量,进而表示出A的体积分数,据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、根据平衡时C的物质的量,利用三段式计算出平衡时各组分的物质的量,进而计算平衡常数.再通入0.36 molA时,假定平衡不移动,恒温恒压下,体积之比等于物质的量之比,据此计算通入0.36 molA时瞬间体积,再计算各物质的量的浓度,进而计算浓度商,与平衡常数比较,判断平衡移动,据此确定.
解答:解:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为
,A的体积分数始终为定值,则x=y,故A正确;
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=
,B的转化率=
,则平衡时,M中的转化率:A<B,故B错误;
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为
×1mol=0.9mol,故A的转化率为
,故C错误;
D、x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,则:
A(g)+3B(g)?2C(g)
起始:1.2 1
反应:0.2 0.6 0.4
平衡:1 0.4 0.4
故A、B、C的平衡浓度分别为0.5mol/L、0.2mol/L、0.2mol/L,
则平衡常数K=
=10
原平衡体系中,2.0L容器中含有分子物质的量为(1.0+0.4+0.mol=1.8mol,当加入0.36molA,体系瞬间有分子物质的量为(1.8+0.36)mol=2.16mol,N容器恒温、恒压,则容器体积比=气体的物质的量比,即:2.16mol:1.8mol=V:2L,瞬间总体积(V)变为
=2.4L,此时的浓度商Qc=
=10.6,Qc>K,所以,平衡要逆向移动,即v(正)<v(逆),故D正确;
故选AD.
A、要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为
| x-z |
| x+y-2z |
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=
| a |
| x |
| 3a |
| 2x |
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为
| 172.8kJ |
| 192kJ |
| 0.9 |
| x |
D、x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,则:
A(g)+3B(g)?2C(g)
起始:1.2 1
反应:0.2 0.6 0.4
平衡:1 0.4 0.4
故A、B、C的平衡浓度分别为0.5mol/L、0.2mol/L、0.2mol/L,
则平衡常数K=
| 0.22 |
| 0.5×0.23 |
原平衡体系中,2.0L容器中含有分子物质的量为(1.0+0.4+0.mol=1.8mol,当加入0.36molA,体系瞬间有分子物质的量为(1.8+0.36)mol=2.16mol,N容器恒温、恒压,则容器体积比=气体的物质的量比,即:2.16mol:1.8mol=V:2L,瞬间总体积(V)变为
| 2.16mol×2L |
| 1.8mol |
(
| ||||
|
故选AD.
点评:本题考查化学平衡的计算、平衡常数的计算等,难度较大,D选项为易错点、难点,注意根据平衡常数判断平衡移动方向,A选项中注意数据的分析处理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
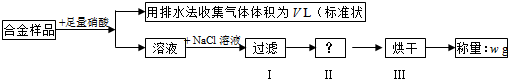
 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
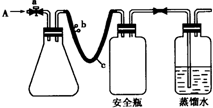 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.