题目内容
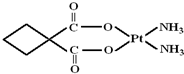 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.①顺铂中的配体有
NH3和Cl-
NH3和Cl-
.(写化学式)②与NH3互为等电子体的分子、离子有
PH3或AsH3、H3O+或CH3-
PH3或AsH3、H3O+或CH3-
.(至少各举一例)③碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其他毒副作用低于顺铂.碳铂的结构为:
碳铂中含有的作用力有
ABCFG
ABCFG
.(填字母)A.极性共价键 B.非极性共价键 C.配位键 D.离子键
E.金属键 F.σ键 G.π键
④碳铂的中心离子的配位数为
4
4
,C原子的杂化方式有sp3和sp2
sp3和sp2
;⑤铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如下图丙所示.
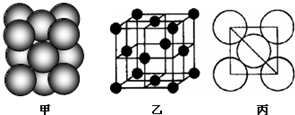
晶胞中铂(Pt)原子的配位数为
12
12
.Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子.请写出A2+在基态时外围电子(价电子)排布式为
3d6
3d6
,B元素在周期表中的位置为第四周期Ⅷ族
第四周期Ⅷ族
.分析:Ⅰ①配位体是指在形成配合物时提供孤对电子的原子或离子;
②等电子体中价电子数相等且原子个数相等,据此判断氨气分子的等电子体;
③同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;
④与中心原子直接相连的配位原子的数目为配位数;根据原子中含有的价层电子对数判断杂化方式;
⑤采用沿X、Y、Z三轴切割的方法确定配位数;
Ⅱ原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VIII族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,A是Fe元素.
②等电子体中价电子数相等且原子个数相等,据此判断氨气分子的等电子体;
③同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;
④与中心原子直接相连的配位原子的数目为配位数;根据原子中含有的价层电子对数判断杂化方式;
⑤采用沿X、Y、Z三轴切割的方法确定配位数;
Ⅱ原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VIII族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,A是Fe元素.
解答:解:Ⅰ①顺铂中氨气分子和氯离子都提供孤电子对,所以氨气分子和氯离子都是配位体;
故答案为:NH3 和Cl-;
②氨气分子中含有4个原子,价电子数是8,所以只要是价电子数是8,含有4个原子的分子或离子与氨气分子就是等电子体,所以PH3 或AsH3、H3O+或CH3- 与氨气分子都是等电子体;
故答案为:PH3 或AsH3、H3O+或CH3-;
③根据其结构知,碳原子和氧原子之间或氮原子和氢原子之间都形成极性共价键,碳原子和碳原子之间存在非极性共价键,铂和碳原子或氮原子之间存在配位键,碳碳单键或氮氢键等都是σ键,碳氧原子间有一个σ键一个π键,故选ABCFG;
④根据图片知,铂原子的配位数是4,碳原子有的含有3个σ键一个π键,有的含有4个σ键,所以碳原子采取sp2和sp3杂化;
故答案为:4,sp3和sp2;
⑤采用沿X、Y、Z三轴切割的方法确定配位数,每个切割面上的配位数是4,共有3个切割面,所以其配位数是12;
故答案为:12;
Ⅱ.根据分析知,A是Fe、B是Co元素,铁失去4s能级上2个电子,导致d能级上的电子为其价电子,所以亚铁离子的价电子排布式为3d6,B是第四周期第VIII族;
故答案为:3d6,第四周期Ⅷ族.
故答案为:NH3 和Cl-;
②氨气分子中含有4个原子,价电子数是8,所以只要是价电子数是8,含有4个原子的分子或离子与氨气分子就是等电子体,所以PH3 或AsH3、H3O+或CH3- 与氨气分子都是等电子体;
故答案为:PH3 或AsH3、H3O+或CH3-;
③根据其结构知,碳原子和氧原子之间或氮原子和氢原子之间都形成极性共价键,碳原子和碳原子之间存在非极性共价键,铂和碳原子或氮原子之间存在配位键,碳碳单键或氮氢键等都是σ键,碳氧原子间有一个σ键一个π键,故选ABCFG;
④根据图片知,铂原子的配位数是4,碳原子有的含有3个σ键一个π键,有的含有4个σ键,所以碳原子采取sp2和sp3杂化;
故答案为:4,sp3和sp2;
⑤采用沿X、Y、Z三轴切割的方法确定配位数,每个切割面上的配位数是4,共有3个切割面,所以其配位数是12;
故答案为:12;
Ⅱ.根据分析知,A是Fe、B是Co元素,铁失去4s能级上2个电子,导致d能级上的电子为其价电子,所以亚铁离子的价电子排布式为3d6,B是第四周期第VIII族;
故答案为:3d6,第四周期Ⅷ族.
点评:本题考查了配合物的有关知识,难度较大,配位数的判断、原子的杂化方式、等电子体等知识点是高考的热点,同时也是学习的难点,要注重基础知识的积累.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
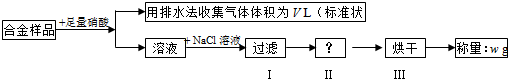
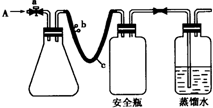 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.