题目内容
(2012?南通模拟)下列各组离子,在指定的环境中一定能大量共存的是( )
分析:A.滴加石蕊试液显红色的溶液,显酸性;
B.离子之间不反应;
C.加入铝粉能产生H2的溶液,为酸或强碱溶液;
D.离子之间发生氧化还原反应.
B.离子之间不反应;
C.加入铝粉能产生H2的溶液,为酸或强碱溶液;
D.离子之间发生氧化还原反应.
解答:解:A.滴加石蕊试液显红色的溶液,显酸性,Fe3+、SCN-结合生成络离子,则不能共存,故A错误;
B.含有大量HCO-3的溶液中离子之间不反应,则能大量共存,故B正确;
C.加入铝粉能产生H2的溶液,为酸或强碱溶液,碱溶液中Fe2+与OH-结合生成沉淀,酸溶液中H+、Fe2+、NO3-发生氧化还原反应,则一定不能共存,故C错误;
D.H+、ClO-、I-离子之间发生氧化还原反应,则不能共存,故D错误;
故选B.
B.含有大量HCO-3的溶液中离子之间不反应,则能大量共存,故B正确;
C.加入铝粉能产生H2的溶液,为酸或强碱溶液,碱溶液中Fe2+与OH-结合生成沉淀,酸溶液中H+、Fe2+、NO3-发生氧化还原反应,则一定不能共存,故C错误;
D.H+、ClO-、I-离子之间发生氧化还原反应,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确离子之间的反应及习题中的信息是解答本题的关键,注意选项中的氧化还原反应为解答的易错点,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
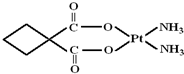 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
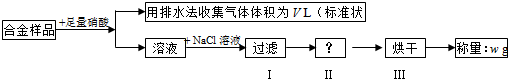
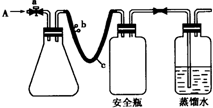 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.