题目内容
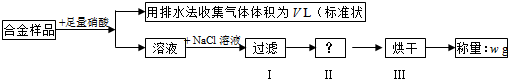
(2012?南通模拟)下列图示实验合理的是( )
分析:A.对应的酸都是最高价氧化物的水化物,可比较非金属性强弱;
B.反应剧烈,不能控制;
C.不能在容量瓶中直接稀释溶液;
D.不能用排水法收集二氧化氮气体.
B.反应剧烈,不能控制;
C.不能在容量瓶中直接稀释溶液;
D.不能用排水法收集二氧化氮气体.
解答:解:A.硫酸与碳酸钠反应生成二氧化碳气体,通入硅酸钠溶液中可观察到浑浊现象,则可证明酸性:硫酸>碳酸>硅酸,对应的酸都是最高价氧化物的水化物,可比较非金属性强弱,故A正确;
B.过氧化钠与水反应剧烈,不能用简易发生装置制备气体,故B错误;
C.不能在容量瓶中直接稀释溶液,应在烧杯中冷却后再转移到容量瓶中,故C错误;
D.二氧化氮与水反应,且易溶于水,不能用排水法收集,故D错误.
故选A.
B.过氧化钠与水反应剧烈,不能用简易发生装置制备气体,故B错误;
C.不能在容量瓶中直接稀释溶液,应在烧杯中冷却后再转移到容量瓶中,故C错误;
D.二氧化氮与水反应,且易溶于水,不能用排水法收集,故D错误.
故选A.
点评:本题考查化学实验方案的评价,题目侧重于物质的性质探究、气体的制备、收集以及溶液的配制等基本实验操作,注意把握实验操作的注意事项,题目难度中等.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 (2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
(2012?南通模拟)Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.1995年WHO对上百种治癌药物进行排名,顺铂的综合评价列第2位.
 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.