题目内容
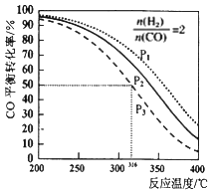
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL, 其pH值与溶液体积V的关系如图所示。下列说法正确的是:
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A溶液的酸性比B溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则酸性:A<B
【答案】C
【解析】
A.因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,故A错误;
B.由图即可得到:当稀释后,A酸的pH明显大于B,则稀释后B的酸性强,故B错误;
C.由图可知,若a=5,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故C正确;
D.若A、B都是弱酸,因B的pH变化小于A,则A的酸性强于B,故D错误;
故答案为C。

【题目】合成甲醇的反应2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(1)写出该反应的平衡常数表达式K=___________________。
(2)该时间段内反应速率v(H2)=______________。
(3)比较此时正、逆反应速率的大小:v正 ___v逆(填“>”、“<”或“=”)
(4)反应达到平衡后,保持其它条件不变,若将容器的体积扩大一倍,v正_____(填“增大”、“减小”或“不变”),v逆______(填“增大”、“减小”或“不变”),平衡向____(填“逆向”、“正向”或“不”)移动,平衡常数K____(填“增大”、“减小”或“不变”)。
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
① 称量1.000 g样品溶于水,配成250 mL溶液;
② 准确量取25.00 mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用0.1000 mol/L 的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)用_______滴定管(填“酸式”或“碱式”)盛装0.1000 mol/L的盐酸标准液。
(2)判断滴定终点到达时的现象_________。
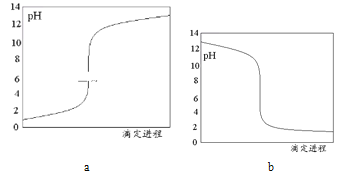
(3)该滴定过程的滴定曲线是下列的______(选填“a”、“b”)。
(4)若出现下列情况,测定结果偏高的是__________。
a 滴定前用蒸馏水冲洗锥形瓶
b 在振荡锥形瓶时不慎将瓶内溶液溅出
c 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
(5)通过计算可知该烧碱样品的纯度为______________。
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大