题目内容
【题目】甲醚是一种淸洁燃料,以![]() =2的比例将混合气体通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)
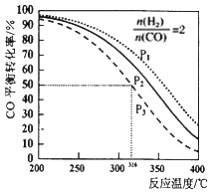
=2的比例将混合气体通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
A. 上述反应△H<0
B. 图中P1<P2<P3
C. 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆)
D. 若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率小于50%
=3,则达到平衡时,CO转化率小于50%
【答案】A
【解析】A.根据图知,相同压强下,升高温度,CO的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,所以正反应是放热反应,则上述反应△H<0,故A正确;B.相同温度下,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,所以压强越大CO的转化率越大,根据图中CO转化率大小顺序知,P1>P2>P3,故B错误;C. ![]() =2,设通入的n(H2)=2xmol、n(CO)=xmol,在P3和316℃时,达到平衡状态时,CO的转化率为50%,
=2,设通入的n(H2)=2xmol、n(CO)=xmol,在P3和316℃时,达到平衡状态时,CO的转化率为50%,
发生的反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
开始(mol/L) x 2x 0 0
反应(mol/L) 0.5x x 0.25x 0.25x
平衡(mol/L) 0.5x x 0.25x 0.25x
根据方程式知,平衡时n(H2)>n(CH3OCH3),要使二者物质的量相等,平衡应该正向移动,则v(正)>v(逆),故C错误;D.相同温度和压强下,增大一种气体反应物浓度,能提高另一种气体物质的转化率,所以增大氢气浓度时能提高CO转化率,则若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率大于50%,故D错误;故选A。
=3,则达到平衡时,CO转化率大于50%,故D错误;故选A。

【题目】利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是
选项 | 甲 | 乙 | 丙 | 实验结论 |
|
A | 苯、液溴 | 铁粉 | AgNO3溶液 | 苯与溴发生取代反应 | |
B | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
C | 浓盐酸 | KMnO4 | 品红溶液 | Cl2具有漂白性 | |
D | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 |
A. A B. B C. C D. D