题目内容
20.以短周期元素回答下列有关问题(稀有气体元素除外)(填相应的元素符号或物质的化学式)(1)金属性最强的元素是Na,非金属性最强的元素是F.
(2)原子半径最大的是Na,适合作半导体的是Si.
(3)其最高价氧化物的水化物具有两性的物质是Al(OH)3,该物质与金属性最强的元素的最高价氧化物的水化物发生的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O.
分析 (1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强;
(2)电子层越多,原子半径越大,同一周期,核电荷数越大,原子半径越小,所以原子半径增大的是Na,半导体材料是硅;
(3)其最高价氧化物的水化物具有两性的物质的元素是铝,对应物质是氢氧化铝,氢氧化铝与氢氧化钠反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O.
解答 解:(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,故短周期元素中,非金属性最强为F,金属性最强的为Na,故答案为:Na;F;
(2)电子层越多,原子半径越大,同一周期,核电荷数越大,原子半径越小,所以原子半径增大的是Na,半导体材料是硅,故答案为:Na、Si;
(3)其最高价氧化物的水化物具有两性的物质的元素是铝,对应物质是氢氧化铝,氢氧化铝与氢氧化钠反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3; Al(OH)3+NaOH=NaAlO2+2H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,1 L庚烷完全燃烧所生成的气态分子数不是$\frac{7}{22.4}$NA | |
| B. | 28 g丙烯中含有的共用电子对数为6NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为9NA |
11.阿司匹林是常见的解热镇痛药,其结构简式如图所示,下列有关说法正确的是( )


| A. | 阿司匹林的分子式为C9H10O4 | B. | 阿司匹林属于有机高分子化合物 | ||
| C. | 1mol阿司匹林最多能与5molH2加成 | D. | 阿司匹林具有酸性,能与NaOH反应 |
8.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图所示,这种药物的研制是基于获得2000年诺贝尔生理学和医学奖、2001年诺贝尔化学奖的研究成果.下列关于 L-多巴酸性质的叙述正确的是( )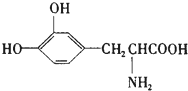

| A. | 只能与碱反应,不能与酸反应 | B. | 1mol该物质最多可与4molNaOH反应 | ||
| C. | 该物质不能使酸性KMnO4褪色 | D. | 1mol该物质最多可与1molHBr反应 |
5.下列关于钠的叙述错误的是( )
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热生成氧化钠 |
9.已知KNO3晶体溶解于水时要吸收热量,从溶液中析出KNO3晶体时会放出热量.若有室温下KNO3饱和溶液20mL,向其中加入1g KNO3晶体,充分搅拌后,下列判断正确的是( )
| A. | 溶液质量增加 | B. | 溶液的温度降低 | ||
| C. | 晶体不再溶解 | D. | 溶液的温度和质量都不变 |
10.通过NO传感器可监测NO的含量,其工作原理如图所示.下列说法错误的是( )


| A. | 该装置实现化学能向电能的转化 | |
| B. | 该电池的总反应为2NO+O2═2NO2 | |
| C. | NiO电极的电极反应式:NO+O2--2e-═NO2 | |
| D. | 当有2.24L的O2参与反应时,转移了0.4mole- |
 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).