题目内容
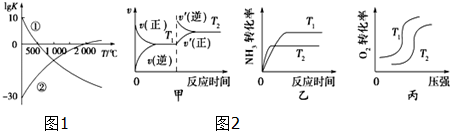
5.下列关于钠的叙述错误的是( )| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热生成氧化钠 |
分析 钠性质活泼,易与氧气、水反应,在自然界中只能以化合态存在,少量钠可保存在煤油中,工业用电解熔融氯化钠的方法制备钠,以此解答.
解答 解:A.因钠活泼,易与水、氧气反应,如在实验室随意丢弃,可引起火灾,实验时剩余的钠粒可放回原试剂瓶中,故A正确;
B.由于钠的金属性强,与空气中的氧气反应生成氧化钠,故B正确;
C.钠性质活泼,易与氧气、水反应,在自然界中只能以化合态存在,故C正确;
D.钠在空气燃烧生成过氧化钠,而不是氧化钠,故D错误.
故选D.
点评 本题考查钠的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
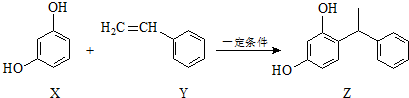
15.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | 上述反应X+Y→Z属于加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
16.氮元素的化合物种类繁多,性质也各不相同
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
①反应开始直至10min时,N2O4的平均反应速率为:0.0025mol/L•min
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
(1)已知
①N2(g)+2O2(g)═N2O4(g)△H=+10.7KJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-624KJ/mol
写出气态肼和N2O4反应生成氮气和液态水的热化学方程式:2H2N4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1258.7kJ/mol
(2)一定温度下,在密闭容器中可逆反应:2NO2(g)?N2O4(g)△H<0,下列叙述正确的是AC
A.单位时间内生成1molN2O4的同时生成2molNO2,达到平衡状态
B.达到平衡后,其它条件不变,升高温度,容器内气体颜色变浅
C.置于绝热的恒容容器中,容器中气体颜色不变时,说明达到平衡状态
D.加入适当的催化剂,NO2的转化率可以增大
(3)在100℃时,将0.400mol的NO2气体充入2L的容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| n(NO2)/mol | 0.400 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②升高温度后,平衡常数K将减低(填“增高”、“减低”或“不变”)
③若在相同情况下向该容器中只充入N2O4气体,要达到上述同样的平衡状态,N2O4的起始物质的量是0.200mol
(4)亚硝酸钠(NaNO2)是一种常见的食品添加剂,具有防腐和增色作用
①亚硝酸钠中氮元素的化合价为+3,由此推断其可能C.(填字母序号)
A.只有氧化性 B.只有还原性 C.既有氧化性,也有还原性
②已知亚硝酸属于弱酸,则NaNO2溶液显碱性;(填“酸性”、“中性”或“碱性”)原因是NO-+H2O?HNO2+OH-.(用离子方程式表示)
(5)肼-空气燃烧电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液,放电时生成N2和水,则放电时负极电极反应式为N2H4-e-+4OH-=N2↑+4H2O.
10.X,Y都是短周期元素,X原子的最外层上有4个电子,Y原子的最外层上有6个电子,则X与Y形成化合物的化学式可能为( )
| A. | XY2 | B. | X2Y4 | C. | YX2 | D. | XY |
17.有八种物质:①甲烷 ②苯 ③聚乙烯 ④聚乙炔 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧环己烯,既能使酸性KMnO4溶液褪色,又能与溴水反应使之褪色的是( )
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
 (X为卤素原子)
(X为卤素原子)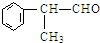 的物质,该物质是一种香料.
的物质,该物质是一种香料.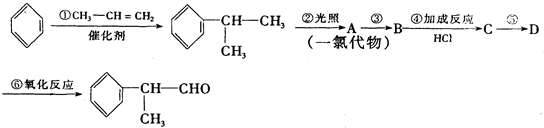
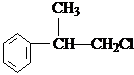 、
、 .
.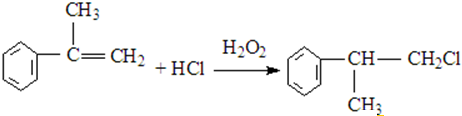 .
.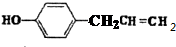 、
、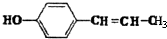 、
、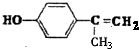 任意2种.
任意2种. 糖类物质为很多生物生命活动提供能量.
糖类物质为很多生物生命活动提供能量.