题目内容
【题目】(15分)草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
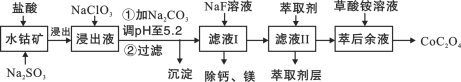
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
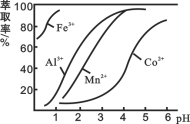
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
【答案】(15分)
(1)Fe3+、Co3+ (2)ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O
(3)R3++3H2O![]() R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀
R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀
(4)除去Mn2+, B (5)0.7
【解析】
试题(1)向水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]中加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,根据元素化合价的变化可知,浸出过程中加入Na2SO3的目的是将Fe3+、Co3+;(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,铁元素的化合价+2→+3,失去电子,产物中氯元素处于最低化合价,则Cl由+5价→-1价,再根据化合价升降相等和电荷守恒、原子守恒配平,则该反应的离子方程式为ClO3- + 6Fe2+ + 6H+ = 6Fe3+ + Cl- + 3H2O。(3)R3++3H2O![]() R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀。(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,则滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B;(5)KSP(CaF2)= c(Ca2+)×c2(F-)=1.05×10-10; KSP(MgF2)= c(Mg2+) ×c2(F-)=7.35×10-11,所以c(Mg2+)/ c (Ca2+)= KSP(MgF2) ÷KSP(CaF2) = 7.35×10-11÷(1.05×10-10)=0.7。
R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀。(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,则滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B;(5)KSP(CaF2)= c(Ca2+)×c2(F-)=1.05×10-10; KSP(MgF2)= c(Mg2+) ×c2(F-)=7.35×10-11,所以c(Mg2+)/ c (Ca2+)= KSP(MgF2) ÷KSP(CaF2) = 7.35×10-11÷(1.05×10-10)=0.7。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】某温度下,在三个体积均为2L的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | a | a | t1 |
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t1 |
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅰ>容器Ⅲ
C.反应到达平衡时,a>0.2 mol
D.起始时向容器Ⅲ中充入0.30 mol PCl5(g)、0.45 molPCl3(g)和0.10 mol Cl2(g),则反应朝逆向进行
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%