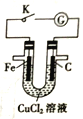
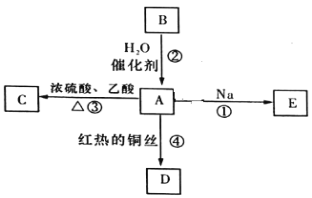
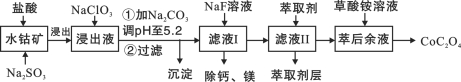
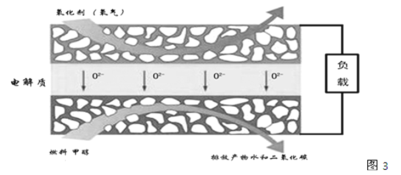
题目内容
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
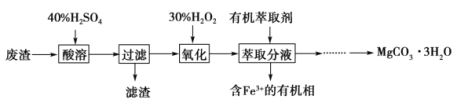
(1)滤渣的成分为_________________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:______________。
(2)加入H2O2一段时间后,溶液中有气泡出现并放热,分析产生气泡的原因:____________(用文字表达)。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并____________________。萃取分液的目的是______________(填字母)。
A.除去水溶液中的铁离子
B.增加镁离子在水中的溶解度
C.富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置后,进行操作:______________________________,确定沉淀完全后,再过滤、__________________、__________________,得到MgCO3·3H2O。
【答案】H2SiO3 H2SiO3+2NaOH═Na2SiO3+2H2O Fe3+催化H2O2分解 检漏 AC 取上层清液少许,滴加Na2CO3溶液,若没有白色沉淀生成 洗涤 低温干燥
【解析】
MgCO3与硫酸反应生成硫酸镁、MgSiO3与硫酸反应生成硫酸镁和硅酸沉淀,铁的氧化物与硫酸反应生成硫酸铁或硫酸亚铁;过滤后向滤液中加入过氧化氢,把Fe2+氧化为Fe3+;萃取除去Fe3+,萃取后得到的水溶液中滴加Na2CO3溶液生成MgCO3·3H2O沉淀。
(1) MgCO3与硫酸反应生成硫酸镁、MgSiO3与硫酸反应生成硫酸镁和硅酸沉淀,所以滤渣的成分为H2SiO3,H2SiO3和氢氧化钠反应生成可溶性硅酸钠,所以过滤装置在使用一段时间后需用NaOH溶液清洗,反应的化学方程式为H2SiO3+2NaOH═Na2SiO3+2H2O。
(2)加入H2O2后,H2O2把Fe2+氧化为Fe3+,Fe3+催化H2O2分解放出氧气,所以溶液中有气泡出现并放热。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并检漏。根据流程图,萃取分液的目的是除去水溶液中的铁离子、富集铁元素,选AC。
(4) 取上层清液少许,滴加Na2CO3溶液,若没有白色沉淀生成说明溶液不含镁离子,镁离子完全沉淀;确定沉淀完全后,再过滤、洗涤、低温干燥,得到MgCO3·3H2O。