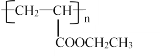题目内容
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。

【答案】4:3 1:1 4 4
【解析】
根据均摊法可知,顶点原子占![]() 、面心原子占
、面心原子占![]() ,棱上原子占
,棱上原子占![]() ,体心原子占1。
,体心原子占1。
根据均摊法可知,甲晶胞中含有1个x原子,y原子的个数是6×![]() =
=![]() ,则x与y的个数比是1:
,则x与y的个数比是1:![]() =4:3;乙晶胞中含有1个a原子,b原子的个数是8×
=4:3;乙晶胞中含有1个a原子,b原子的个数是8×![]() =1,则a与b的个数比是1:1;丙晶胞中c离子的个数是1+12×
=1,则a与b的个数比是1:1;丙晶胞中c离子的个数是1+12×![]() =4,d离子的个数是8×
=4,d离子的个数是8×![]() +6×
+6×![]() =4,故答案为:4:3;1:1;4;4。
=4,故答案为:4:3;1:1;4;4。

【题目】一定温度下,10mL0.40molL-1H2O2在MnO2作用下发生反应 :2H2O2 ( aq)=2H2O(l )+O2( g) △H <0, 不同时刻测定生成O2的物质的量如下表所示 :
t/min | 0 | 3 | 6 | 10 | ……. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)
A.升高温度,可加快H2O2 的分解速率
B.若增大溶液起始浓度,则收集到 0.0 008 mol O2 的时间会小于3 min
C.反应至 6min 时,溶液 中 c(H2O2)=0.2mol L-1
D.反应至 12min 时,H2O2分解率为 65%
【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
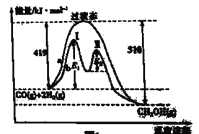
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
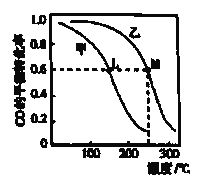
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)
(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。