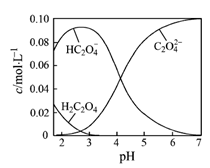
题目内容
【题目】铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材作阴、阳极材料,经过电解处理形成氧化铝膜,抗蚀能力强。其制备的简要流程如图所示。下列用来解释流程中反应的方程式不正确的是
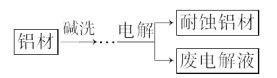
A. 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3===2AlO2-+H2O
B. 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 获得耐蚀铝材的电极反应:4Al-12e-+3O2===2Al2O3
D. 用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+===NH4++H2O
【答案】C
【解析】
A.氧化铝为两性氧化物,与强碱反应生成盐和水,反应的离子方程式:2OH-+Al2O3=2AlO2-+H2O,A正确;B.铝与强碱溶液反应生成偏铝酸盐和氢气,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,B正确;C.获得耐蚀铝材的电极反应为:2Al+3H2O-6e-=Al2O3+6H+,C错误;D.用稀氨水洗去耐蚀铝材表面的酸,离子方程式:NH3H2O+H+=NH4++H2O,D正确;答案选C。

【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。