题目内容
25℃时,将0.1mol?L-1氨水溶液加水稀释,下列数值变大的是( )
| A、c(OH-) | ||
| B、pH | ||
C、
| ||
| D、c(H+)?c(OH-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:25℃时,将0.1mol?L-1氨水溶液加水稀释,促进一水合氨电离,但溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小,但溶液中c(H+)增大,据此分析解答.
解答:
解:A.加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,故A错误;
B.加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,溶液的pH减小,故B错误;
C.氨水溶液加水稀释,促进一水合氨电离,溶液中n(NH3.H2O)减小、c(NH4+)增大,所以
增大,故C正确;
D.温度不变,水的离子积常数不变,所以c(H+)?c(OH-)不变,故D错误;
故选C.
B.加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,导致溶液中c(OH-)减小,溶液的pH减小,故B错误;
C.氨水溶液加水稀释,促进一水合氨电离,溶液中n(NH3.H2O)减小、c(NH4+)增大,所以
| c(NH4+) |
| c(NH3?H2O) |
D.温度不变,水的离子积常数不变,所以c(H+)?c(OH-)不变,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确“加水稀释虽然促进NH3.H2O电离但溶液中c(OH-)、c(NH3.H2O)、c(NH4+)都减小”的原因是解本题关键,注意水的离子积常数只与温度有关,与溶液酸碱性无关,为易错点.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
氯仿可作为局部麻醉剂,常因保存不慎而被空气中的O2氧化,产生剧毒的气体-光气(COCl2):2CHCl3+O2→2COCl2+2HCl.下列说法正确的是( )
| A、上述反应属于取代反应 |
| B、检验氯仿是否变质可选用的试剂是AgNO3溶液 |
| C、CH2Cl2有两种结构,说明CH4是正四面体结构 |
| D、CHCl3是常见的有机溶剂,大量使用对环境无影响 |
“绿色化学”是一个日渐为人们所熟悉的社会概念,绿色食品的基本标准是( )
①香甜可口 ②无污染 ③表面呈绿色 ④无化学添加剂 ⑤有营养价值.
①香甜可口 ②无污染 ③表面呈绿色 ④无化学添加剂 ⑤有营养价值.
| A、②④⑤ | B、①②③⑤ |
| C、①③④⑤ | D、全部 |
下列离子方程式正确的是( )
| A、小苏打溶液中加入醋酸:HCO3-+H+═CO2↑+H2O |
| B、碳酸氢铵溶液和足量氢氧化钠溶液混合:NH4++OH-═NH3?H2O |
| C、NaHS水解:HS-+H2O═S2-+H3O+ |
| D、硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
具有平面结构的有机物(如图)的一氯代物数目共有( )
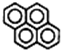

| A、1 | B、2 | C、3 | D、4 |
下列金属冶炼的原理错误的是( )
A、Cu2S+O2
| ||||
B、Fe2O3+2Al
| ||||
C、MgO+CO
| ||||
D、2Cr+Al2O3
|
关于0.1mol/L Na2CO3溶液的叙述错误的是( )
| A、0.5L该溶液中钠离子的物质的量浓度为0.05mol/L |
| B、1L该溶液中含有Na2CO3的质量为10.6g |
| C、从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.1mol/L |
| D、取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L |
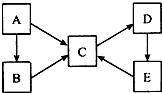 A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示:
A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示: