题目内容
关于0.1mol/L Na2CO3溶液的叙述错误的是( )
| A、0.5L该溶液中钠离子的物质的量浓度为0.05mol/L |
| B、1L该溶液中含有Na2CO3的质量为10.6g |
| C、从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.1mol/L |
| D、取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、根据碳酸钠的化学式可知,C(Na+)=2C(Na2CO3);
B、根据n=cV计算碳酸钠的物质的量,再根据m=nM计算碳酸钠质量;
C、溶液是均匀的,溶液的浓度与所取体积无关;
D、根据稀释定律,溶液稀释前后溶质的物质的量不变,列式计算.
B、根据n=cV计算碳酸钠的物质的量,再根据m=nM计算碳酸钠质量;
C、溶液是均匀的,溶液的浓度与所取体积无关;
D、根据稀释定律,溶液稀释前后溶质的物质的量不变,列式计算.
解答:
解:A、由碳酸钠的化学式可知,C(Na+)=2C(Na2CO3)=0.2mol/L,故A错误;
B、1L0.1mol/LNa2CO3溶液含有Na2CO3的质量为1L×0.1mol/L×106g/mol=10.6g,故B正确;
C、溶液是均匀的,溶液的浓度与所取体积无关,所以取出的100ml碳酸钠溶液与原碳酸钠溶液浓度相同仍然为0.1mol/L,故C正确;
D、令稀释后的浓度为c,根据稀释定律,溶液稀释前后溶质的物质的量不变,所以10ml×0.1mol/L=100ml×c,解得c=0.01mol/L,故D正确.
故选:A.
B、1L0.1mol/LNa2CO3溶液含有Na2CO3的质量为1L×0.1mol/L×106g/mol=10.6g,故B正确;
C、溶液是均匀的,溶液的浓度与所取体积无关,所以取出的100ml碳酸钠溶液与原碳酸钠溶液浓度相同仍然为0.1mol/L,故C正确;
D、令稀释后的浓度为c,根据稀释定律,溶液稀释前后溶质的物质的量不变,所以10ml×0.1mol/L=100ml×c,解得c=0.01mol/L,故D正确.
故选:A.
点评:本题主要考查物质的量浓度计算及理解,难度不大,注意公式的运用与基础知识的掌握,溶质离子浓度与溶质浓度的关系.

练习册系列答案
相关题目
25℃时,将0.1mol?L-1氨水溶液加水稀释,下列数值变大的是( )
| A、c(OH-) | ||
| B、pH | ||
C、
| ||
| D、c(H+)?c(OH-) |
关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①
②Ur-(aq)+Na+(aq)?NaUr(s).下列叙述正确的是( )
①

②Ur-(aq)+Na+(aq)?NaUr(s).下列叙述正确的是( )
| A、反应②的正反应为吸热反应 |
| B、增加Na+浓度,反应②平衡向逆反应方向移动 |
| C、反应②正反应为放热反应 |
| D、改变Na+浓度,对反应①平衡无影响 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐.下列说法正确的是( )
| A、原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B、X的单质分子中存在s-pσ键 |
| C、测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D、Y的单质分子中有一个p-pσ键和二个p-pπ键 |
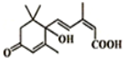 2012年广州市大街小巷对大量盆栽鲜花施用了诱抗素剂,以保证鲜花盛开,诱抗素的分子结构如图,下列关于该分子说法正确的是( )
2012年广州市大街小巷对大量盆栽鲜花施用了诱抗素剂,以保证鲜花盛开,诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、诱抗素含有碳碳双键、羟基、羰基、羧基 |
| B、诱抗素能与氯化铁溶液发生显色反应 |
| C、诱抗素能发生加成反应、水解反应、氧化反应 |
| D、1mol诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同 |
| D、二者在一定的条件下可以相互转化 |
下列说法错误的是( )
A、
| ||||
B、
| ||||
| C、14C和14N的质量数相等,它们的中子数不等 | ||||
| D、12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
将浓硫酸敞口放置在空气中,其质量会□,浓度会□,在此过程中浓硫酸表现□性( )
| A、增大,减小,吸水性 |
| B、减小,增大,脱水性 |
| C、增大,增大,强还原性 |
| D、减小,减小,强氧化性 |
下列说法正确的是( )
| A、CO2分子的空间结构是直线形,故CO2分子是非极性分子 |
| B、分子CO和N2的原子总数相同,价电子总数相等,故性质相同 |
| C、Na+的电子排布式为1s22s22p63s1 |
| D、在元素周期表中,s区,d区和ds区的元素都是金属 |