题目内容
【题目】将13.6gFe、Fe2O3和CuO的混合粉末加入到100mL一定物质的量浓度的盐酸中,充分反应,生成标准状况下的氢气896mL,过滤,滤渣经洗涤、干燥后得到1.28g固体纯净物,经检验滤液中只含有一种溶质。请回答:
(1)固体混合物中CuO的质量___。
(2)盐酸的浓度为___。
【答案】1.60g 3.60molL-1
【解析】
(1)根据氧化性的强弱顺序判断反应的先后顺序,推测1.28g固体纯净物的成分,再进一步确定CuO的质量;
(2) 盐酸的浓度c(HCl) =c(H+)=c(Cl-),滤液中只含有一种溶质,易知是FeCl2,若计算出Fe2+的物质的量,则可以计算出n(Cl-) ,从而得出盐酸的浓度。
(1)根据氧化性强弱:Fe3+>Cu2+>H+,Fe涉及的相关反应按①②③顺序发生下列三组反应:①Fe2O3~2HCl ~2FeCl3 ,2FeCl3+ Fe = 3FeCl2;
②CuO~2HCl~CuCl2 , CuCl2+Fe= FeCl2 + Cu;
③ 2HCl+Fe= FeCl2+H2↑。
依据题意易推知1.28g固体纯净物为铜,物质的量为0.02mol,逆推可判断固体混合物中含有0.02molCuO,质量为1.60g,故固体混合物中CuO的质量为1.60g。
(2)设与Fe2O3反应的Fe的物质的量为xmol,
①Fe2O3 ~Fe ~ 3FeCl2; ②CuO ~ Fe ~ FeCl2 ~ Cu;
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③ 2HCl ~ Fe ~ FeCl2 ~ H2↑
![]()
![]()
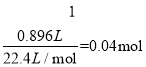
则160x + 56(x+0.02+0.04)+80×0.02 =13.6,求得x=0.04mol,可知n(FeCl2)= 0.04×3 +0.02+0.04=0.18mol ,n(Cl-)=2n(FeCl2)=0.36mol,c(Cl-)=![]() =
=![]() =3.60mol/L,则盐酸浓度为3.60mol/L。
=3.60mol/L,则盐酸浓度为3.60mol/L。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案