题目内容
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
【答案】N2(g) +3H2(g)=2NH3(g) △H=-92.2kJ/mol N2(g)+O2(g)=2NO(g) △H=+68kJ/mol Cu(s)+![]() O2(g)=CuO(s) △H=-157kJ/mol
O2(g)=CuO(s) △H=-157kJ/mol
【解析】
热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,据此解答。
(1) 1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量,则该反应的热化学方程式为:N2(g) +3H2(g)=2NH3(g) △H=-92.2kJ/mol;
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量,则该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) △H=+68kJ/mol;
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量,则该反应的热化学方程式为:Cu(s)+![]() O2(g)=CuO(s) △H=-157kJ/mol。
O2(g)=CuO(s) △H=-157kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:
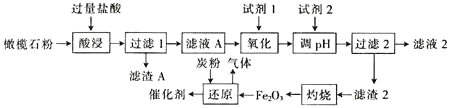
金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。
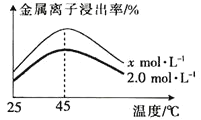
x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
【题目】实验室需配制0.2000molL﹣1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
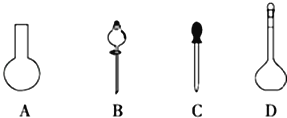
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是_________(填字母),还缺少的玻璃仪器是_________(填仪器名称)。
(2)根据计算需用天平称取Na2S2O3固体的质量是_________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________(填“>”“<”或“=”,下同)0.2000molL﹣1.若还未等溶液冷却就定容了,则所得溶液浓度_________0.2000molL﹣1。
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000molL﹣1Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为_________。
②NaClO溶液的物质的量浓度是_________。