题目内容
【题目】氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.已知在酸性条件下,KMnO4被还原为Mn2+。用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O,当有6mol H2SO4参加反应的过程中,有___mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的离子方程式为___。
(3)取300mL2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则消耗KMnO4的物质的量的是___mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是___。
【答案】10 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O 0.72 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ H+与NO3-组成的硝酸把Fe2+氧化
【解析】
(1)在3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O中H2O2中氧元素化合价从-1价升高为0价,是还原剂,且每3molH2SO4参加反应,有5molH2O2被氧化;
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,自身被还原生成MnSO4,同时溶液中还生成K2SO4、H2O,据此写出发生反应的离子方程式;
(3)n(KI)=0.3L×2mol/L =0.6mol,与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则n(KIO3)=0.6mol,结合化合价的变化计算转移的电子的数目,可计算消耗KMnO4的物质的量;
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,铁离子和亚硫酸根离子反应生成亚铁离子导致溶液呈浅绿色;硝酸能将亚铁离子氧化生成铁离子。
(1)在3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O中H2O2中氧元素化合价从-1价升高为0价,是还原剂,且每3molH2SO4参加反应,有5molH2O2被氧化,则当有6mol H2SO4参加反应的过程中,有![]() =10mol H2O2被氧化。
=10mol H2O2被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,自身被还原生成MnSO4,根据原子守恒知,同时溶液中还生成K2SO4、H2O,发生反应方程式为2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,则该反应的离子方程式为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O;
(3)n(KI)=0.3L×2mol/L =0.6mol,与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则n(KIO3)=0.6mol,转移电子的物质的量为0.6mol×6=3.6mol,KMnO4的还原产物为Mn2+,则由电子守恒可知消耗KMnO4的物质的量为![]() =0.72mol;
=0.72mol;
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,铁离子和亚硫酸根离子发生氧化还原反应生成亚铁离子导致溶液呈浅绿色,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;酸性条件下,硝酸根离子具有强氧化性,所以硝酸能将亚铁离子氧化生成铁离子,则溶液又变为黄色。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质的检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
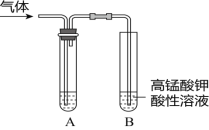
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 无水乙醇与浓硫酸共热,反应的化学方程式是______ | ___ |
② | 乙烯 | 溴乙烷与NaOH的乙醇溶液共热,反应的化学方程式是_____ | ___ |
③ | 乙炔 | 向电石中滴加饱和食盐水,反应的化学方程式是___ | ____ |
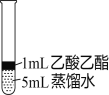
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴中加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管②中反应的化学方程式是__________。
(2)设计试管③实验的作用是__________。
(3)实验结论是__________。
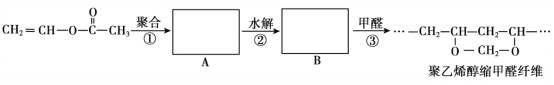
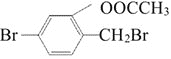
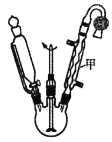
【题目】乙酰乙酸乙酯在医药上常用于合成维生素B。某化学小组在实验室中用如图装置制备乙酰乙酸乙酯。
已知:ⅰ.2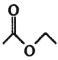
![]()
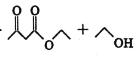
ⅱ.有关物质的性质:
沸点/℃ | 水中溶解性 | |
乙酸乙酯 | 77.2 | 难溶 |
乙酰乙酸乙酯 | 181 | 微溶 |
乙酸 | 118 | 易溶 |
实验步骤:
①向三颈烧瓶中加入9.2g无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
②向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
③水层用5mL无水乙酸乙酯萃取,分液。
④将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
⑤粗产品纯化得到乙酰乙酸乙酯4.2g。
回答下列问题:
(1)仪器甲的名称是__,水从__(填“上”或“下”)口进入。
(2)步骤②中加入饱和食盐水的作用是__。
(3)步骤④中洗涤时用饱和NaHCO3溶液,目的是__。
(4)步骤⑤中粗产品纯化的操作名称是__。
(5)本实验的产率为__%(结果保留3位有效数字)。